-
在25℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是
A.CH3OH(l)+
O2(g)=CO2(g)+2H2O(l);ΔH=+725.8 kJ/mol
B.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l);ΔH=-1452 kJ/mol
C.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l);ΔH=-725.8 kJ/mol
D.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l);ΔH=+1452 kJ/mol
难度: 中等查看答案及解析
-
已知反应:①101kPa时,2C(s)+O2(g)==2CO(g);ΔH=-221 kJ/mol
②稀溶液中,H+(aq)+OHˉ(aq)==H2O(l);ΔH=-57.3 kJ/mol
下列结论正确的是
A.碳的燃烧热大于110.5 kJ/mol
B.①的反应热为221 kJ/mol
C.稀硫酸与稀Ba(OH) 2溶液反应的中和热为-57.3 kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量
难度: 中等查看答案及解析
-
将a g块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如下图的实线所示。在相同的条件下,将b g(a>b)粉末状碳酸钙与同浓度盐酸反应,则相应的曲线(图中虚线所示)正确的是

难度: 中等查看答案及解析
-
在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g)
1/2N2(g)+CO2(g);ΔH=-373.2 kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
A.加催化剂同时升高温度 B.加催化剂同时增大压强
C.升高温度同时充入N2 D.降低温度同时增大压强
难度: 中等查看答案及解析
-
对可逆反应4NH3(g) + 5O2(g)
4NO(g) + 6H2O(g),下列叙述正确的是
A.达到化学平衡时,4v正(O2) = 5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3) = 3v正(H2O)
难度: 中等查看答案及解析
-
若1体积硫酸恰好与10体积pH=11的氢氧化钠溶液完全反应,则二者物质的量浓度之比应为
A.10∶1 B.5∶1 C.1∶1 D.1∶10
难度: 中等查看答案及解析
-
有等体积、等pH的Ba(OH)2、NaOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是
A.V3>V2>V1 B.V3=V2=V1 C.V3>V2=V1 D.V1=V2>V3
难度: 中等查看答案及解析
-
将纯水加热至较高温度,下列叙述正确的是
A.水的离子积变大、pH变小、呈酸性
B.水的离了积不变、pH不变、呈中性
C.水的离子积变小、pH变大、呈碱性
D.水的离子积变大、pH变小、呈中性
难度: 中等查看答案及解析
-
在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡:CH3COOH
CH3COO-+H+对于该平衡,下列叙述正确的是
A.加入水时,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向正反应方向移动
C.加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减小
D.加入少量CH3COONa固体,平衡向正反应方向移动
难度: 中等查看答案及解析
-
反应:A(g)+3B(g)
2C(g) ΔH<0达平衡后,将气体混合物的温度降低,下列叙述中正确的是
A.正反应速率加大,逆反应速率变小,平衡向正反应方向移动
B.正反应速率变小,逆反应速率加大,平衡向逆反应方向移动
C.正反应速率和逆反应速率都变小,平衡向正反应方向移动
D.正反应速率和逆反应速率都变小,平衡向逆反应方向移动
难度: 中等查看答案及解析
-
相同体积的pH=3的强酸溶液和弱酸溶液分别跟足量的镁完全反应,下列说法正确的是
A.弱酸溶液产生较多的氢气 B.强酸溶液产生较多的氢气
C.两者产生等量的氢气 D.无法比较两者产生氢气的量
难度: 中等查看答案及解析
-
用蒸馏水稀释1 mol·L-1醋酸时,始终保持增大趋势的是
A、溶液中的c(CH3COO-) B、溶液中的c(H+)
C、溶液中的c(CH3COOH) D、溶液中的c(OH-)
难度: 中等查看答案及解析
-
常温下测得某无色溶液中由水电离出c(H+)为10-13 mol/L, 该溶液中一定能大量共存的离子组是
A.K+、Na+、NO3-、SO42- B.K+、Na+、Cl-、CO32-
C.Mg2+、K+、NO3-、Cl- D.Fe2+、NO3-、SO42-、NH4+
难度: 中等查看答案及解析
-
某温度下,在一容积可变的容器中,反应2A(g)+B(g)
2C(g)达到平衡时,A、B和C的物质的量分别为4 mol、2 mol和4 mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是
A.均减半 B.均加倍 C.均增加1 mol D.均减少1 mol
难度: 中等查看答案及解析
-
合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的放热反应:N2(g)+ 3H2(g)
2NH3(g),673 K,30 MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。
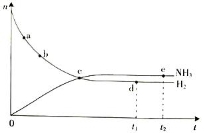
下列叙述正确的是
A.点a的正反应速率比点b的小
B.点c处反应达到平衡
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.其他条件不变,773 K下反应至t1时刻,n(H2)比上图中d点的值大
难度: 中等查看答案及解析
-
室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,叙述错误的是
A.该溶液的pH=4
B.升高温度,溶液的pH增大
C.此酸的电离平衡常数约为1×10-7
D.由HA电离出的c(H+)约为水电离出的c(H+)的106倍
难度: 中等查看答案及解析
-
下列关于化学反应的自发性叙述中正确的是
A.焓变小于0而熵变大于0的反应肯定是自发的
B.焓变和熵变都小于0的反应肯定是自发的
C.焓变和熵变都大于0的反应肯定是自发的
D.熵变小于0而焓变大于0的反应肯定是自发的
难度: 中等查看答案及解析
-
下列说法正确的是
A.强电解质溶液的导电能力一定比弱电解质溶液的强
B.氨气是弱电解质,铜是强电解质
C.氧化钠是强电解质,醋酸是弱电解质
D.硫酸钠是强电解质,硫酸钡是弱电解质
难度: 中等查看答案及解析
-
在一定温度不同压强(p1<p2)下,可逆反应2X(g)
2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数(
)与反应时间(t)的关系有以下图示,正确的是

难度: 中等查看答案及解析
-
常温时,将pH=6的CH3COOH溶液加水稀释1000倍后,溶液中的
A.pH=9 B.c(OH-)≈10-5mol·L-1.
C.pH≈7 D.c(OH-)≈10-8 mol·L-1.
难度: 中等查看答案及解析