-
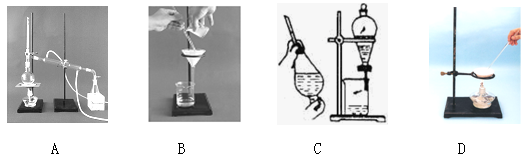
下列是一些实验操作的示意图,其中不正确的是 ( )

A B C D
难度: 简单查看答案及解析
-
“以人为本,安全至上”,下列化学实验操作的事故处理方法正确的是( )
A.不慎将浓碱溶液沾在皮肤上,要立即用硫酸或盐酸冲洗
B.不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛
C.酒精灯着火时立即用水扑灭
D.氢氧化钠固体洒落到地板上立即用水冲洗
难度: 简单查看答案及解析
-
下列各组混合物中,能用分液漏斗进行分离的一组混合物是( )
A.酒精和水 B.碘和四氯化碳
C.水和四氯化碳 D.氯化钠和水
难度: 简单查看答案及解析
-
下列关于胶体的叙述中,不正确的是 ( )
A.胶体是一种相对稳定的分散系 B.用滤纸能分离胶体和悬浊液
C.利用丁达尔效应可以区分溶液和胶体 D.胶体中分散质粒子的直径小于1 nm
难度: 简单查看答案及解析
-
下列物质中,属于电解质的是 ( )
A.稀盐酸 B.Cu丝 C.NaCl D.蔗糖
难度: 简单查看答案及解析
-
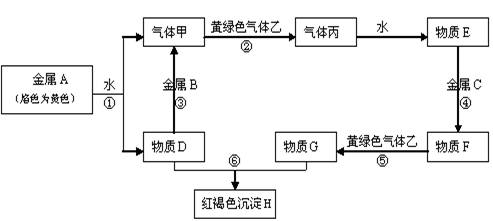
据中央电视台焦点访谈报道,2008年6月中旬,在黑龙江省哈尔滨市的一个居民小区,同住一栋楼的两家人相继得上一种病:红细胞、白细胞、血小板严重偏低。经黑龙江省辐射监督管理站的专家检测,发现是放射性物质铱-192在作怪。则
Ir中的中子数与质子数之差为( )
A.115 B.38 C.269 D.154
难度: 简单查看答案及解析
-
用如图表示的一些物质或概念间的从属关系中不正确的是 ( )
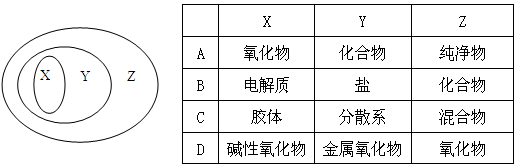
难度: 简单查看答案及解析
-
下列各组物质中化学键的类型相同的是 ( )
A. HCl MgCl2 NH4Cl B. NH3 H2O CO2
C. CaCl2 NaOH H2O D. H2O Na2O CO2
难度: 简单查看答案及解析
-
下列说法正确的是 ( )
A.摩尔质量就是相对分子质量 B.摩尔是物质的量的单位
C.H2SO4的摩尔质量是98 g D.1 mol H2的质量是2 g/mol
难度: 简单查看答案及解析
-
下表是某人体检的部分指标,其中是用物质的量浓度来表示的是 ( )

A.甘油三酯 B.谷丙转氨酶 C.肌酸磷酸激酶 D. 白蛋白
难度: 简单查看答案及解析
-
将Na2O2投入FeCl2溶液中, 可观察到的现象是 ( )
A.生成白色沉淀、有气泡产生 B.生成红褐色沉淀、有气泡产生
C.生成浅绿色沉淀、有气泡产生 D.生成黑色沉淀,有气泡产生
难度: 简单查看答案及解析
-
下列有关纯碱和小苏打的叙述中正确的是 ( )
A.Na2CO3和NaHCO3都既能与酸反应,又能与氢氧化钠溶液反应
B.等质量的Na2CO3、NaHCO3与足量的稀H2SO4反应,NaHCO3产生CO2比Na2CO3多
C.向NaHCO3溶液中滴入Ba(OH)2溶液无沉淀,而Na2CO3溶液中加入Ba(OH)2溶液出现白色沉淀
D.等质量的Na2CO3、NaHCO3与足量的同种盐酸反应,NaHCO3消耗的酸比Na2CO3多
难度: 简单查看答案及解析
-
镭是元素周期表中第七周期第IIA族元素,关于其叙述不正确的是 ( )
A.镭的金属性比钙弱 B.单质能与水反应生成H2
C.在化合物中呈+2价 D.碳酸镭难溶于水
难度: 简单查看答案及解析
-
若阿伏加德罗常数的数值用NA表示,下列说法正确的是 ( )
A.标准状况下,1.12L氦气所含原子数为0.1NA
B.1.6gNH2-离子所含质子数为NA
C.22.4 LHCl溶于水,溶液中H+数为NA
D.9g D2O所含的中子数为4.5NA
难度: 简单查看答案及解析
-
用98%的浓硫酸(密度为1.84g/cm3 )配制100 mL lmol/L的稀硫酸。现给出下列仪器(配制过程中可能用到):①100 mL量筒 ②10 mL量筒 ③50 mL烧杯 ④托盘天平 ⑤100 mL容量瓶 ⑥胶头滴管 ⑦玻璃棒,所需仪器按顺序排列正确的是 ( )
A.④③⑦⑤⑥ B.②⑤⑦⑥ C.①③⑤⑥⑦ D.②⑥③⑦⑤⑥
难度: 简单查看答案及解析
-
在酸性溶液中,能大量共存的离子是( )
A.Mg2+、Fe3+、NO3-、SCN- B.Al3+、Fe2+、Cl-、NO3-
C.K+、 Na+、 Cl-、 HCO3- D.Na+、Ba2+、NO3-、SO42-
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是 ( )
A.FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl-
B.金属钠和水的反应:Na+2H2O = H2↑+Na++2OH-
C.Al(OH) 3沉淀中滴加盐酸 :Al(OH) 3+3H+ = Al3++3H2O
D.AlCl3溶液中加入过量氨水:Al3++4OH-=
+2H2O
难度: 简单查看答案及解析
-
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如图所示,由此确定,原溶液中含有的阳离子是( )
A.Mg2+、Al3+、Fe2+ B.H+、Mg2+、Al3+
C.H+、Ba2+、Al3+ D.只有Mg2+、Al3+
难度: 简单查看答案及解析
-
被称为万能还原剂的NaBH4(NaBH4中H为-1价)能溶于水并和水反应,有如下反应NaBH4+2H2O=NaBO2+4H2↑,下列有关该反应的说法中,正确的是 ( )
A.NaBH4既是氧化剂又是还原剂 B.NaBH4是氧化剂,H2O是还原剂
C.硼元素被氧化,氢元素被还原 D.被氧化的元素与被还原的元素质量比为1∶1
难度: 简单查看答案及解析
-
向含0.2molAlCl3的溶液中加入了一定量的1mol/L的NaOH溶液后,生成了7.8克的沉淀,则加入的NaOH溶液的体积为 ( )
A.100ml B.200ml C.300ml D.400ml
难度: 简单查看答案及解析