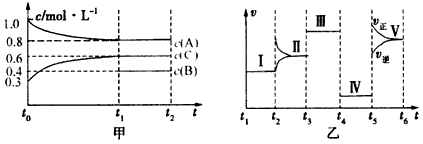
-
能源可划分为一级能源和二级能源,自然界以现成方式提供的能源称为一级能源;需依靠其他能源的能量间接制取的能源称为二级能源。氢气是一种高效而没有污染的二级能源,它可以由自然界中大量存在的水来制取;未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列叙述正确的是( )
A.水煤气,电能是一级能源
B.天然气,水力是二级能源
C.核能,煤,石油符合未来新能源标准
D.太阳能,生物质能,风能,氢能符合未来新能源标准
难度: 简单查看答案及解析
-
在2A+B
3C+4D反应中,表示该反应速率最快的是( )
A.v(A)=0.5mol/(L·s ) B.v(B)=0.3mol/(L·s)
C.v(C)=0.8mol/(L·s ) D.v(D)=1mol/(L·s)
难度: 中等查看答案及解析
-
S(单斜)和S(正交)是硫的两种同素异形体。
已知:①S(单斜,s)+O2(g)=SO2(g) ΔH1=-297.16 kJ·mol-1
②S(正交,s)+O2(g)=SO2(g) ΔH2=-296.83 kJ·mol-1
③S(单斜,s)=S(正交,s) ΔH3
下列说法正确的是( )
A.ΔH3=+0.33 kJ·mol-1
B.单斜硫转化为正交硫的反应是吸热反应
C.S(单斜,s)=S(正交,s) ΔH3<0,正交硫比单斜硫稳定
D.S(单斜,s)=S(正交,s) ΔH3>0,单斜硫比正交硫稳定
难度: 中等查看答案及解析
-
在CH3COOH
H++CH3COO-的电离平衡中,要使电离平衡右
移且氢离子浓度增大,应采取的措施是( )
A.加入NaOH B.
加入纯醋酸 C.加水 D.降低温度
难度: 简单查看答案及解析
-
把3molP和2.5molQ置于2L密闭容器中,发生如下反应:3P(g)+Q(g)
x M(g)+2N(g),5min后达到平衡生成1molN,经测定M的平均速率是0.1mol/(L•min),下列叙述不正确的是
A.P的平均反应速率为0.15 mol/(L•min)
B.Q的平衡浓度为1 mol/L
C.
Q的转化率为25%
D.x等于2
难度: 中等查看答案及解析
-
下列事实不能用勒夏特列原理解释的是( )
A.开启啤酒瓶后,瓶中马上泛起大量泡沫
B.钢铁在潮湿的空气中容易生锈
C.实验室中常用排饱和食盐水的方法收集氯气
D.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.增大压强,活化分子数增加,化学反应速率一定增大
B.升高温度,活化分子百分数增加,化学反应速率一定增大
C.加入反应物,使活化分子百分数增加,化学反应速率增大
D.使用催化剂,降低了反应的活化能、反应速率加快,但是活化分子百分数不变
难度: 中等查看答案及解析
-
常温下,某溶液中由水电离产生的c(H+)=10—12mol/L,则下列各组离子在该溶液中一定可以大量共存的是( )
A.K+、Na+、AlO2—、Cl— B.Na+、Cl—、SO42—、HCO3—
C.NH4+、Na+、NO3—、SO42— D.Ba2+、Na+、Cl—、NO3—
难度: 中等查看答案及解析
-
对一定温度下的恒容容器中的可逆反应A(g)+3B(g)
2C(g),下列叙述不能作为平衡标志的是( )
①C的生成速率与C的分解速率相等
②单位时间内生成amolA,同时生成3amolB
③A、B、C的浓度不再变化
④A、B、C的压强不再变化
⑤混合气体的总压强不再变化
⑥混合气体的物质的量不再变化
⑦A、C的物质的量之比不再变化
⑧A、B、C的分子数之比为1:3:2
A.②⑧ B.①⑥ C.②④ D.③⑧
难度: 中等查看答案及解析
-
用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是( )
A.c(H+) B.
C.c(H+)和c(OH-)的乘积 D.OH-的物质的
量
难度: 中等查看答案及解析
-
在一定条件下,对于反应mA(g)+nB(g)
cC(g)+dD(g),C物质的含量(c%)与温度、压强的关系如图所示,下列判断正确的是( )
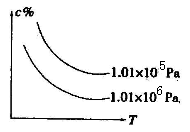
A.ΔH<0 ΔS>0 B.ΔH>0 ΔS<0
C.H>0 ΔS>0 D.H<0 ΔS<0
难度: 中等查看答案及解析
-
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)
I3-(aq),某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是( )
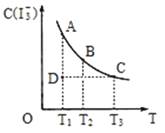
A.I2(aq)+I-(aq)
I3-(aq)的△H>0
B.若温度T1,T2的平衡常数分别为K1,K2,则K1<K2
C.反应进行到状态D时,一定有V正>V逆
D.状态A与状态B相比,状态A的c(I2)大
难度: 困难查看答案及解析
-
下列表述中,关于“一定”说法正确的个数是( )
①pH=6的溶液一定是酸性溶液
②c(H+)>c(OH-)一定是酸性溶液
③强电解质溶液的导电能力一定大于弱电解质溶液的导电能力
④25℃时,水溶液中水电离出的c(H+)和水电离出的c(OH-)的乘积一定等于10-14
⑤如果Na2Y的水溶液显中性,该溶液中一定没有电离平衡
⑥0.2mol/L氢硫酸溶液加水稀释,电离程度增大,c(H+)一定增大
⑦温度保持不变,向水中加入钠盐对水的电离一定没有影响
⑧使用pH试纸测定溶液pH时若先润湿,则测得溶液的pH一定有影响
A.0 B.1 C.2 D.3
难度: 中等查看答案及解析
-
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
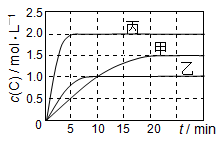
容器
甲
乙
丙
容积
0.5 L
0.5 L
1.0 L
温度/℃
T1
T2
T2
反应物
起始量
1.5 mol A
0.5 mol B
1.5 mol A
0.5 mol B
6.0 mol A
2.0 mol B
下列说法正确的是( )
A.平衡后,向甲容器中再充入0.5 mol A,A和B的转化率均增大
B.达到平衡时反应吸收的热量:Q丙> 2Q乙
C.若平衡时保持温度不变,改变容器体积平衡不移动
D.T1℃,起始时甲容器中充入0.5 mol A、1.5 mol B,平衡时A的转化率为25%
难度: 困难查看答案及解析
-
25 ℃时某些弱酸的电离平衡常数如下表所示:
CH3COOH
HClO
H2CO3
K(CH3COOH)
=1.8×10-5
K(HClO)
=3.0×10-8
K(H2CO3)a1=4.4×10-7
K(H2CO3)a2=4.7×10-11
常温下,稀释CH3COOH、HClO两种酸时,溶液的pH随加水量变化的曲线如图所示,下列说法正确的是( )
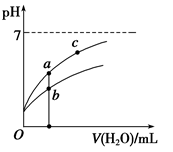
A.相同浓度的CH3COOH和HClO的混合溶液中,各离子浓度的大小关系是:
c(H+)>c(ClO-)>c(CH3COO-)>c(OH-)
B.图像中a、c两点所处的溶液中
相等(HR代表CH3COOH或HClO)
C.图像中a点酸的浓度大于b点酸的浓度
D.向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O=2HClO+CO32—
难度: 困难查看答案及解析
-
可逆反应①X(g)+2Y(g)
2Z(g) 、②2M(g)
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
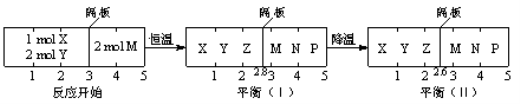
下列判断正确的是( )
A.反应①的正反应是吸热反应
B.达平衡(I)时体系的压强与反应开始时体系的压强之比为14:15
C.在平衡(I)和平衡(II)中M的体积分数相等
D.达平衡(I)时,X的转化率为5/11
难度: 困难查看答案及解析