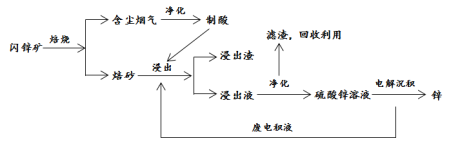
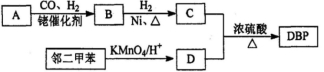
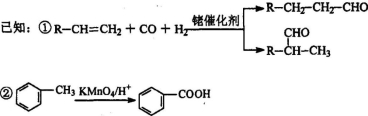
-
下列说法正确的是( )
A.高分子化合物油脂在人体内水解为高级脂肪酸酸和甘油等小分子才能被吸收
B.现代科技已经能够拍到氢键的“照片”,直观地证实了水分子间的氢键是一个水分子中的氢原子与另一个水分子中的氧原子间形成的化学键
C.我国已能利用3D打印技术,以钛合金粉末为原料,通过激光熔化逐层堆积,来制造飞机钛合金结构件,高温时可用金属钠还原相应的氯化物来制取金属钛
D.用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理相同
难度: 中等查看答案及解析
-
某同学在研究前18号元素时发现,可以将它们排成如下图所示的“蜗牛”形状,图中每个“·”代表一种元素,其中O点(最中心的点)代表起点元素。下列正确的是( )
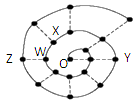
A.物质YO可能具有较强的氧化性
B.图中离O点越远的元素,其原子半径一定越大
C.O2X、WO3分子内都含有氢键,所以沸点都较高
D.科学家发现一种新细菌的DNA链中有砷(As)元素,该As元素最有可能取代了普通DNA链中的Z元素
难度: 中等查看答案及解析
-
在某温度时,将n mol•L-1氨水滴入10mL1.0 mol•L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是 ( )
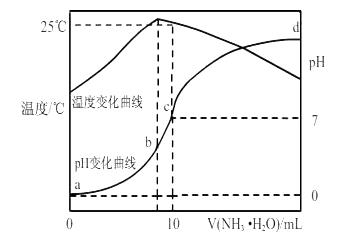
A.a点Kw=1.0×10-14
B.水的电离程度: b > c > a> d
C.b点:C(NH4+) > C(Cl-) > C(H+) > C(OH-)
D.25℃时NH4Cl水解常数为(n-1)×10-7 mol•L-1
难度: 困难查看答案及解析
-
某无色溶液,由Na+、Ag+、Ba2+、Al3+、AlO、MnO、CO32-、SO42-中的若干种组成,取该溶液进行如下实验:
① 取适量试液,加入过量盐酸,有气体生成,并得到澄清溶液;
② 在①所得溶液中再加入过量碳酸氢铵溶液,有气体生成;同时析出白色沉淀甲;
③ 在②所得溶液中加入过量Ba(OH)2溶液,也有气体生成,并有白色沉淀乙析出。
根据对上述实验的分析判断,最后得出的结论合理的是( )
A.不能判断溶液中是否存在SO42- B.溶液中一定不存在的离子是CO32-
C.不能判断溶液中是否存在Ag+ D.不能判断是否含有 AlO 离子
难度: 困难查看答案及解析
-
下列实验方案能达到实验目的的是( )
实验方案
实验目的或结论
A
将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色
可证明氧化性:H2O2比Fe3+强
B
向1 mL 1%的NaOH溶液中加入2 mL 2%的CuSO4溶液,振荡,再加入0.5 mL有机物Y,加热,未出现砖红色沉淀
说明Y中不含醛基
C
取a g铝箔与足量氢氧化钠溶液充分反应,逸出的气体通过浓硫酸后,测其体积为V L(已转化为标准状况下)
测定铝箔中氧化铝的含量
D
比较不同反应的反应热数据大小
从而判断反应速率的大小
难度: 困难查看答案及解析
-
下列有关说法正确的是( )
A.实验室制氢气,为了加快反应速率,可向稀 H2SO4 中滴加少量 Cu(NO3)2 溶液
B.N2(g)+3H2(g)
2NH3(g) ΔH<0,仅升高温度,达平衡时氢气转化率增大
C.吸热反应“TiO2(s)+2Cl2(g) =TiCl4(g)+O2(g)”一定条件下可自发进行,则该反应ΔS<0
D.在稀AgNO3溶液中加入过量 NaCl溶液,产生白色沉淀,再加入少量 Na2S溶液,出现黑色沉淀,则加入Na2S溶液后 c(Ag+) 更小了
难度: 困难查看答案及解析
-
下列说法不正确的是( )
A.油脂发生皂化反应能生成甘油
B.乙炔、丙烯酸(CH2=CHCOOH)、醋酸乙烯酯(CH3COOCH=CH2)均可作为合成聚合物的单体
C.蔗糖及其水解产物均能与新制氢氧化铜反应生成红色沉淀
D.谷氨酸分子
 缩合最多形成2种二肽(不考虑立体异构)
缩合最多形成2种二肽(不考虑立体异构)难度: 中等查看答案及解析