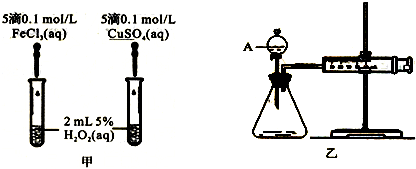
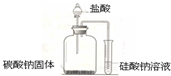
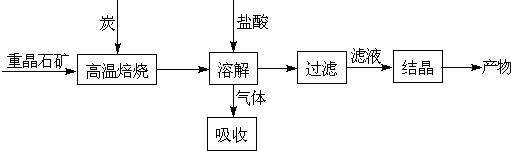
-
在由水电离产生的H+浓度为1×10-13mol•L-1的溶液中,一定能大量共存的离子组是( )
①K+、Cl-、NO3-、S2- ②K+、Fe2+、I-、SO42- ③Na+、Cl-、NO3-、SO42-④Na+、Ca2+、Cl-、HCO3- ⑤K+、Ba2+、Cl-、NO3-.
A.①③
B.③⑤
C.③④
D.②⑤难度: 中等查看答案及解析
-
某溶液中含有:①NO3-②HCO3-③SO32-④CO32-⑤SO42-等五种阴离子,向其中加入少量Na2O2固体后,溶液中离子浓度基本保持不变的是( )
A.①③
B.①③⑤
C.①
D.①④⑤难度: 中等查看答案及解析
-
下列反应中生成物总能量高于反应物总能量的是( )
A.碳酸钙受热分解
B.乙醇燃烧
C.铝与氧化铁粉未反应
D.氧化钙溶于水难度: 中等查看答案及解析
-
为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行以下五项操作:①过滤;②加过量NaOH溶液;③加适量稀盐酸;④加过量Na2CO3溶液;⑤加过量BaCl2溶液,正确的是( )
A.①④②⑤③
B.④①②⑤③
C.②⑤④①③
D.②④⑤①③难度: 中等查看答案及解析
-
下列有关强电解质叙述正确的是( )
A.强电解质在熔化状态下一定能够导电
B.共价化合物可能是强电解质
C.难溶物一定不是强电解质
D.强电解质的水溶液一定具有很强的导电能力难度: 中等查看答案及解析
-
下列可用于测定溶液PH且精确度最高的是( )
A.酸碱指示剂
B.PH计
C.精密PH试纸
D.广泛PH试纸难度: 中等查看答案及解析
-
氯气溶于水达到平衡后,若其他条件不变,只改变某一条件,下列叙述正确的是( )
A.加入少量水,水的电离平衡向正反应方向移动
B.再通入少量氯气,减少
C.通过少量SO2,溶液漂白性增强
D.加入少量固体Na2O2,一定有c(Na+)=c(Cl-)+c(ClO-)难度: 中等查看答案及解析
-
下列过程或现象与盐类水解无关的是( )
A.纯碱溶液除油污
B.浓硫化钠溶液有臭味
C.加热氯化铁溶液颜色变深
D.铁在潮湿的环境下生锈难度: 中等查看答案及解析
-
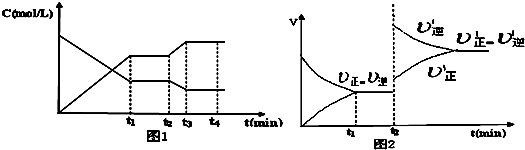
对H2(g)+I2(g)
2HI(g) 反应,如图所示若a表示υ(H2)消耗,则b可表示( )

A.υ(I2)消耗
B.υ(HI)生成
C.υ(HI)消耗
D.υ(H2)生成难度: 中等查看答案及解析
-
纯净的NaCl并不潮解,但家庭所用的食盐因含有MgCl2杂质而易于潮解.为得到纯净的氯化钠,有人设计这样方法:把买来的食盐放入纯NaCl的饱和溶液中一段时间,过滤即得纯净的NaCl固体,对此有下列说法,其中正确的是( )
A.食盐颗粒大一些有利于提纯
B.设计实验的根据是MgCl2比NaCl易溶于水
C.设计实验的根据是NaCl的溶解平衡
D.在整个过程中,溶液中NaCl的物质的量浓度会变大难度: 中等查看答案及解析
-
灰锡(以粉末状存在)和白锡是锡的两种同素异形体.已知:
①Sn(s,白)+2HCl(aq)═SnCl2(aq)+H2(g)△H1
②Sn(s,灰)+2HCl(aq)═SnCl2(aq)+H2(g)△H2
③Sn(s,灰)Sn(s,白)△H3=+2.1kJ•mol-1,下列说法正确的是( )
A.△H1>△H2
B.锡在常温下以灰锡状态存在
C.灰锡转为白锡的反应是放热反应
D.锡制器皿长期处在低于13.2℃的环境中,会自行毁坏难度: 中等查看答案及解析
-
往含I-和Cl-的稀溶液中滴入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如右图所示.则原溶液中c(I-)/c(Cl-)的比值为( )

A.(V2-V1)/V1
B.V1/V2
C.V1/(V2-V1)
D.V2/V1难度: 中等查看答案及解析
-
在一定条件下,固定容积的密闭容器中的反应:2NO2(g)⇌O2(g)+2NO(g);△H>0,达到平衡时,若改变其中一个条件X,Y随X的变化符合图中曲线的是( )
A.当X表示温度时,Y表示NO2的物质的量
B.当X表示压强时,Y表示NO的转化率
C.当X表示反应时间时,Y表示混合气体的密度
D.当X表示NO2的物质的量时,Y表示O2的物质的量难度: 中等查看答案及解析
-
某酸HX的稀溶液和某碱YOH的稀溶液的物质的量浓度相等,两溶液混合后,溶液的PH大于7,表中判断合理的是( )
编号 HX YOH 溶液的体积关系 ① 强酸 强碱 V(HX)=V(YOH) ② 强酸 强碱 V(HX)<V(YOH) ③ 强酸 弱碱 V(HX)=V(YOH) ④ 弱酸 强碱 V(HX)=V(YOH)
A.①③
B.②③
C.①④
D.②④难度: 中等查看答案及解析
-
现有常温下pH=1的某强酸溶液10mL,下列操作能使溶液的pH变成2的是( )
A.加入10mL0.01mol/L的NaOH溶液
B.加入10mL的水进行稀释
C.加水稀释成100mL
D.加入10mL0.01mol/L的盐酸难度: 中等查看答案及解析
-
t℃时,水的离子积为 Kw,该温度下将amol/L一元酸HA与bmol/L一元碱BOH等体积混合,若混合后溶液呈中性,下列说法一定正确的是( )
A.混合液中,C(H+)=
B.混合液的pH=7
C.a=b
D.混合液中,c(B+)=c(A-)+c(OH-)难度: 中等查看答案及解析