-
2007年诺贝尔化学奖得主Gerhard Ertl对金属Pt表面催化CO氧化反应的模型进行了深入研究。下列关于
Pt的说法正确的是( )
A.
Pt和
Pt是同一种核素 B.
Pt和
Pt互称为同位素
C.
Pt和
Pt的性质完全相同 D.
Pt和
Pt互称为同素异形体
难度: 简单查看答案及解析
-
下列离子中,电子数大于质子数,且中子数大于质子数的是( )
A H3O+ B Li+ C OH- D TD–
难度: 简单查看答案及解析
-
下列排列顺序正确的是( )
A.热稳定性:H2O>H2S>SiH4 B.原子半径:Na>N>Al
C.酸性:H3PO4>H2SO4>HClO4 D.碱性:NaOH>Be(OH)2>Mg(OH)2
难度: 简单查看答案及解析
-
在离子RO3n - 中共有x 个核外电子,R 原子的质量数为A ,则R 原子核内含有的中子数为( )
A. A + n + 48 – x B. A + n + 24 – x
C. A - n + 24 – x D. A - n - 24 – x
难度: 简单查看答案及解析
-
三种短周期元素A、B、C,可形成简单离子A+、B-、C2-,A、B同周期,A+ 和C2-具有相同的电子层结构。下列说法中正确的是( )
A.原子序数:A>B>C B.原子核外最外层电子数:B>C>A
C.离子半径: B->A+>C2- D.原子半径: B>A>C
难度: 简单查看答案及解析
-
下列各表中的数字代表的是原子序数,表中数字所表示的元素与它们在元素周期表中的位置相符的是( )
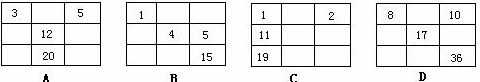
难度: 简单查看答案及解析
-
某元素Z的核外电子数等于核内中子数,取其单质2.8 g 与O2完全反应,可得6 g化合物ZO2 ,Z 元素在周期表中位置是( )
① 第3周期 ②第2周期 ③ 第ⅣA 族 ④ 第ⅤA族
A.①② B.①④ C.①③ D. ②③
难度: 简单查看答案及解析
-
下列事实中,不能用于判断元素失电子能力强弱的是( )
A 金属间发生的置换反应
B 金属元素的最高价氧化物对应水化物的碱性强弱
C 金属元素的单质与水或酸反应置换出氢气的难易
D 每摩尔金属单质在反应中失去电子的多少
难度: 简单查看答案及解析
-
Y 元素最高正价与负价的绝对值之差是4;Y元素与M 元素形成化合物,并在水中电离出电子层结构相同的离子,该化合物是( )
A.KCl B.Na2S C.Na2O D.K2S
难度: 简单查看答案及解析
-
下列化合物中阴离子半径和阳离子半径之比最大的是( )
A.NaCl B.CsF C.LiI D.KBr
难度: 简单查看答案及解析
-
元素性质呈周期性变化的决定因素是( )
A.元素原子半径大小呈周期性变化 B.元素原子量依次递增
C.元素原子核外电子排布呈周期性变化 D.元素的最高正化合价呈周期性变化
难度: 简单查看答案及解析
-
某元素原子的最外层电子数是次外层电子数的3倍,且最外层电子数与次外层电子数之和小于10。该元素为( )。
A.锂 B.铍 C.氧 D.钙
难度: 简单查看答案及解析
-
下列说法中错误的是( )
A.化学反应中的能量变化通常表现为热量的变化
B.化学键的断裂和形成是化学反应中能量变化的主要原因
C.需要加热才能发生的反应一定是吸热反应
D.反应物总能量和生成物总能量的相对大小决定了反应是放出能量还是吸收能量
难度: 简单查看答案及解析
-
某元素X 的最高价含氧酸的化学式为HnXO2n-2 ,则在某气态氢化物中,X 元素的化合价为( )
A 5n - 12 B 3n – 12 C 3n - 6 D n – 10
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.离子化合物中一定不含共价键
B.共价化合物中一定不含离子键
C.金属元素和非金属元素之间形成的化学键一定是离子键
D.全部由非金属元素形成的化合物一定是共价化合物
难度: 简单查看答案及解析
-
下列说法不正确的是( )
① 质子数相同的粒子一定属于同种元素 ② 同位素的性质几乎完全相同 ③ 质子数相同,电子数也相同的粒子,不可能是一种分子和一种离子 ④ 电子数相同的粒子不一定是同一种元素 ⑤ 一种元素只能有一种质量数 ⑥ 某种元素的相对原子质量取整数,就是其质量数
A ①②④⑤ B ③④⑤⑥ C ②③⑤⑥ D ①②⑤⑥
难度: 简单查看答案及解析
-
下列说法中不正确的是( )
A 位于周期表中同一周期的元素,原子具有相同的电子层数
B 凡是位于周期表中同一周期的元素,都是按从左到右的顺序原子核外最外层电子数由1递增至8
C凡是位于周期表中同一主族的元素,原子具有相同的最外层电子数
D凡是位于周期表中同一主族的元素,都是按从上到下的顺序原子核外电子层数逐渐递增
难度: 简单查看答案及解析
-
已知1∽18号元素的离子aW3+、bX+、cY2-、dZ- 四种离子的电子层结构相同,下列关系正确的是( )
A 质子数c > d B 离子的还原性Y2- > Z-
C 氢化物的稳定性H2Y > HZ D 原子半径X < W
难度: 简单查看答案及解析
-
某元素R 的单质1.8 g 与足量盐酸反应,生成标准状况下的氢气2.24 L。此单质与氧形成的化合物的化学式为R2 O3 ,又知R 元素原子核内质子数比中子数少1。R是( )
A Ga B B C Fe D Al
难度: 简单查看答案及解析
-
核内中子数为N 的R2+,质量数为A ,则m g 其氧化物中所含质子的物质的量为( )
A m/A+16 (A – N + 8)mol B m/A+16 (A – N + 10)mol
C (A – N - 2)mol D m/A (A – N + 6)mol
难度: 简单查看答案及解析