-
2014年是门捷列夫诞辰180周年,下列事实不能用元素周期律解释的只有
A.相对原子质量:Ar > K B.碱性:KOH > NaOH
C.酸性:HClO4 > H2SO4 D.元素的金属性:Mg > Al
难度: 中等查看答案及解析
-
下列化学用语正确的是
A.硫原子的原子结构示意图:
B.过氧化钠的电子式:Na+[
]2-Na+
C.原子核内有8个质子、10个中子的氧原子:
D.HClO的结构式为 H—Cl—O
难度: 中等查看答案及解析
-
下列说法正确的是
A.同温同压下,H2 + Cl2 = 2HCl在光照和点燃条件的△H不同
B.铅蓄电池在放电过程中,负极质量减小,正极质量增加
C.天然气、沼气和水煤气分别属于化石能源、可再生能源和一级能源
D.元素原子的核外电子排布呈周期性变化是元素性质呈现周期性变化的根本原因
难度: 中等查看答案及解析
-
在理论上不能用于设计原电池的化学反应是
A.2FeCl3(aq)+2KI(aq) = 2FeCl2(aq)+2KCl(aq)+I2(aq) △H <0
B.Ba(OH)2·8H2O(s)+2NH4Cl(s) = BaCl2(aq)+2NH3·H2O(aq)+8H2O(1) △H >0
C.4Al(s)+ 6H2O(1)+ 3O2(g)==4Al(OH)3(s) △H <0
D.Zn(s)+2MnO2(s)+2H2O(1) = 2MnOOH(s) +Zn(OH)2(s) △H <0
难度: 中等查看答案及解析
-
下图中每条折线表示周期表ⅣA~ⅦA族中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的是
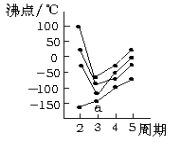
A.H2S B.HCl C.SiH4 D.PH3
难度: 中等查看答案及解析
-
反应A+B→C(△H<0)分两步进行:①A+B→X(△H>0),②X→C(△H<0)。下列示意图中,能正确表示总反应过程中能量变化的是

难度: 中等查看答案及解析
-
下列各组中两种微粒所含电子数不相等的是
A.H3O+和OH― B.CO和N2 C.HNO2和NO2― D.CH3+和NH4+
难度: 中等查看答案及解析
-
放射性同位素14C可用来推算文物的“年龄”。14C的含量每减少一半要经过约5730年。某考古小组挖掘到一块动物骨骼,经测定14C还剩余1/8,推测该动物生存年代距今约为
A.5730×3年 B.5730×4年 C.5730×6年 D.5730×8年
难度: 中等查看答案及解析
-
为了测定酸碱反应的中和热,计算时至少需要的数据是
①酸的浓度和体积 ②碱的浓度和体积 ③比热容 ④反应后溶液的质量
⑤生成水的物质的量 ⑥反应前后温度变化 ⑦操作所需的时间
A.①②③⑥ B.①③④⑤ C.③④⑤⑥ D.全部
难度: 中等查看答案及解析
-
一种充电电池放电时的电极反应为:
H2+2OH-−2e-=2H2O; NiO(OH)+H2O+e-=Ni(OH)2+OH-
当为电池充电时,与外电源正极连接的电极上发生的反应是
A.H2O的还原 B.NiO(OH)的还原
C.H2的氧化 D.Ni(OH)2的氧化
难度: 中等查看答案及解析
-
下列热化学方程式书写正确的是(△H的绝对值均正确)
A.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g) △H=—1367.0 kJ/mol(燃烧热)
B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l)△H=+57.3kJ/mol(中和热)
C.S(s)+O2(g)===SO2(g) △H=—269.8kJ/mol(反应热)
D.2NO2===O2+2NO △H=+116.2kJ/mol(反应热)
难度: 中等查看答案及解析
-
白磷与氧可发生如下反应:P4+5O2 === P4O10。已知断裂下列化学键需要吸收的能量分别为:P-P:a kJ·mol-1、P-O:b kJ·mol-1、P=O:c kJ·mol-1、O=O:d kJ·mol-1,根据图示的分子结构和有关数据估算该反应的△H,其中正确的是

A.(6a+5d-4c-12b) kJ·mol-1
B.(4c+12b-6a-5d) kJ·mol-1
C.(4c+12b-4a-5d) kJ·mol-1
D.(4a+5d-4c-12b) kJ·mol-1
难度: 中等查看答案及解析
-
下列说法正确的是
①离子化合物一定含离子键,也可能含极性键或非极性键
②共价化合物一定含共价键,也可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在共价键
⑥熔融状态能导电的化合物一定是离子化合物
A.①③⑤ B.②④⑥ C.②③④ D.①③⑥
难度: 中等查看答案及解析
-
2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系。下列叙述不正确的是

A.a为电池的正极
B.电池充电反应为LiMn2O4=Li1-xMn2O4+xLi
C.放电时,a极锂的化合价发生变化
D.放电时,溶液中的Li+从b向a迁移
难度: 中等查看答案及解析
-
根据碘与氢气反应的热化学方程式
(i) I2(g)+ H2(g)
2HI(g) △H=-9.48 kJ/mol
(ii) I2(s)+H2(g)
2HI(g) △H=+26.48 kJ/mol
下列判断正确的是
A.254g I2(g)中通入2g H2(g),反应放热9.48 kJ
B.反应(ii)的反应物总能量比反应(i)的反应物总能量低
C.反应(i)的产物比反应(ii)的产物稳定
D.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
难度: 中等查看答案及解析
-
有一种燃料电池,所用燃料为H2和空气,电解质为熔融的K2CO3。电池的总反应式为2H2+O2===2H2O,负极反应为H2+CO32--2e-===H2O+CO2。该电池放电时,下列说法中正确的是
A.正极反应为2H2O+O2+4e-===4OH-
B.CO32-向负极移动
C.电子由正极经外电路流向负极
D.电池中CO32-的物质的量将逐渐减少
难度: 中等查看答案及解析
-
室温下,将1mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1;将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为ΔH2;CuSO4·5H2O受热分解的化学方程式为:CuSO4·5H2O(s)
CuSO4(s) +5H2O(
),热效应为ΔH3。则下列判断正确的是
A.ΔH2>ΔH3 B.ΔH1<ΔH3
C.ΔH1+ΔH3=ΔH2 D.ΔH1+ΔH2=ΔH3
难度: 中等查看答案及解析
-
短周期元素W、X、Y和Z的原子序数依次增大。元素W是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍。下列说法不正确的是
A.元素W、X的氯化物中,各原子均满足8电子的稳定结构
B.元素X与氢形成的原子个数比为1:4的化合物中只含有极性共价键
C.元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成
D.元素Z可与元素X形成共价化合物XZ2
难度: 中等查看答案及解析
-
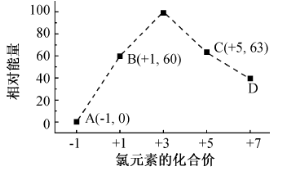
如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是

A.原子半径:Z>Y>X
B.气态氢化物的热稳定性:W>R
C.WX3和水反应生成的化合物是离子化合物
D.Y和Z两者最高价氧化物对应的水化物之间能相互反应
难度: 中等查看答案及解析
-
铅蓄电池的工作原理为:Pb+PbO2+2H2SO4
2PbSO4+2H2O,研读下图,下列判断不正确的是
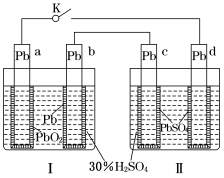
A.K闭合时,d电极反应式:PbSO4+2H2O-2e-===PbO2+4H++SO42-
B.当电路中转移0.2 mol电子时,Ⅰ中消耗的H2SO4为0.2 mol
C.K闭合时,Ⅱ中SO42-向c电极迁移
D.K闭合一段时间后,Ⅱ可单独作为原电池,d电极为正极
难度: 困难查看答案及解析

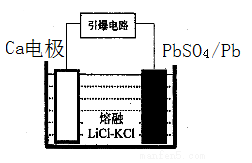
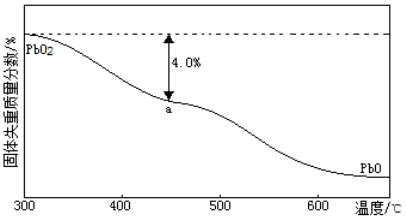
 )的残留固体,若a点固体组成表示为PbOx或mPbO2·nPbO,则计算x=
)的残留固体,若a点固体组成表示为PbOx或mPbO2·nPbO,则计算x=