-
有人认为人体实际上是一架缓慢氧化着的“高级机器”,人体在生命过程中也需要不断的补充“燃料”。按照这种观点,你认为人们通常摄入的下列物质不能看作“燃料”的是:
A.淀粉类物质 B.水 C.脂肪类物质 D.蛋白质
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A.反应AlCl3+4NaOH===NaAlO2+3NaCl+2H2O,可以设计成原电池
B.Zn和稀硫酸反应时,加入少量CuSO4溶液能加快产生H2的速率
C.把Fe片和Cu片放入稀硫酸中,并用导线把二者相连,观察到Cu片上产生大量气泡,说明Cu与H2SO4能发生反应而Fe被钝化
D.Zn-Cu原电池工作过程中,溶液中H+向负极作定向移动
难度: 简单查看答案及解析
-
下列表示物质结构的化学用语或模型正确的是
A.8个中子的碳原子的符号:12C B.HF的电子式:H+
C.Cl—离子的结构示意图:
 D.CH4分子的比例模型:
D.CH4分子的比例模型:
难度: 简单查看答案及解析
-
下列关于热化学反应的描述中正确的是
A.HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ/mol
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的ΔH=+566.0kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷燃烧热
难度: 中等查看答案及解析
-
最近科学家发现了氧元素的一种新的粒子O4 。对于这种新粒子,下列说法不正确的是
A.它是氧气的一种同素异形体 B.它是氧元素的一种同位素
C.它的摩尔质量是64g﹒mol-1 D.它具有很强的氧化性
难度: 简单查看答案及解析
-
对可逆反应4NH3(g)+5O2(g)
4NO(g)+6H2O(g),下列叙述中正确的是
A.达到化学平衡时4v正(O2)=5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增大容器的体积,则正反应速率减小,逆反应速率增大
D.化学反应速率的关系是2v正(NH3)=3v正(H2O)
难度: 中等查看答案及解析
-
暖宝宝(如图所示)采用的是铁的“氧化放热”原理,使其发生原电池反应,铁粉在原电池中充当

A.负极 B.正极
C.阴极 D.阳极
难度: 简单查看答案及解析
-
下列有关化学反应速率和限度的说法中,正确的是( )
A.铁与硝酸反应时,其他条件一定时,硝酸越浓,反应速率越快
B.在金属钠与足量水反应中,增加水的量能加快反应速率
C.在2SO2+O2
2SO3反应中加入18O2,达到平衡后SO2中不可能含有18O
D.无论是吸热还是放热反应,加热都能加快化学反应速率
难度: 简单查看答案及解析
-
已知R2+离子核外有a个电子,b个中子。表示R原子符号正确的是
A.
B.
C.
D.
难度: 简单查看答案及解析
-
可逆反应H2(g)+I2(g)== 2HI (g)达到平衡时的标志是( )
A、混合气体密度恒定不变 B、混合气体的颜色不再改变
C、H2、I2、HI的浓度相等 D、H2、I2、HI在混合气体中体积分数相等
难度: 中等查看答案及解析
-
可给笔记本电脑供电的甲醇燃料电池已经面世,其结构示意图如下。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一电极后与氧气反应,电池总反应为:2CH3OH+3O2=2CO2+4H2O。下列说法不正确的是
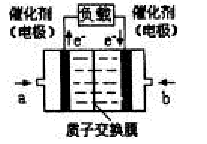
A.右电极为电池正极,b处通入的物质是空气
B.左电极为电池负极,a处通入的物质是空气
C.负极反应式为:CH3OH+H2O-6e—=CO2+6H+
D.正极反应式为:O2+4H++4e—=2H2O
难度: 简单查看答案及解析
-
已知:①1 mol H2 分子中化学键断裂时需要吸收 436kJ 的能量
②1 mol Cl2 分子中化学键断裂时需要吸收 243kJ 的能量
③由H原子和Cl原子形成1mol HCl分子时释放 431kJ 的能量
则下列叙述正确的是( )
A.氢气和氯气反应生成氯化氢气体的热化学方程式是 H2(g) + Cl2(g) = 2HCl(g)
B.氢气和氯气反应生成 2 mol 氯化氢气体,反应的△H = 183kJ/mol
C.氢气和氯气反应生成 2 mol 氯化氢气体,反应的△H =-183kJ/mol
D.氢气和氯气反应生成 1 mol 氯化氢气体,反应的△H =-183kJ/mol
难度: 中等查看答案及解析
-
已知中和热的数值是57.3KJ/mol。下列反应物混合时,产生的热量等于57.3KJ的是( )
A.1mol/L稀HCl(aq)和1mol/L稀NaOH(aq)
B.500mL2.0mol/L的HCl(aq)和500mL2.0mol/L的NaOH(aq)
C.500mL2.0mol/L的CH3COOH(aq)和500mL2.0mol/L的NaOH(aq)
D.1mol/L稀CH3COOH(aq)和1mol/L稀NaOH(aq)
难度: 简单查看答案及解析
-
在5 L的密闭容器中,一定条件下发生化学反应:2NO(g)+2CO(g)
N2(g)+2CO2(g)。起始反应时NO和CO各为3 mol,保持密闭容器体积不变,10秒钟达到化学平衡,测得N2为1 mol。下列有关反应速率的说法中,正确的是
A.达到平衡后,若将容器体积压缩为2 L,则正反应速率将增大,逆反应速率将减小
B.反应前5秒钟内,用CO表示的平均反应速率为0.04 mol·L-1·s-1
C.当v正(CO)=2v逆(N2)时,该反应中NO的物质的量不再改变
D.保持压强不变,往容器中充入1 mol He,正、逆反应速率都不改变
难度: 简单查看答案及解析
-
纯锌跟稀H2SO4反应速率很小,为了加快锌的溶解和放出H2的速率,并且使产生H2的量不变,当稀H2SO4过量时,可向其中加少量( )
A.CuSO4溶液 B.铜 C.ZnSO4 D.镁条
难度: 简单查看答案及解析
-
在气体参与的反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法是( )
①增大反应物的浓度 ②升高温度 ③增大压强 ④移去生成物 ⑤加入催化剂
A.①②③ B.①②③⑤ C.②⑤ D.①②③④⑤
难度: 简单查看答案及解析
-
在一定温度下的定容密闭容器中,当物质的下列物理量不再变化时,不能说明反应A(s)+2B(g)
C(g)+D(g)已达平衡状态的是
A.混合气体的压强 B.混合气体的密度
C.B的物质的量浓度 D.气体的平均相对分子质量
难度: 中等查看答案及解析
-
炽热的炉膛内有反应:C(s)+O2(g)==CO2(g);△H = -392KJ/mol,往炉膛内通入水蒸气时,有如下反应:C(s)+H2O(g)==H2(g)+CO(g);△H = +131KJ/mol,CO(g)+1/2O2(g)==CO2(g);△H = -282KJ/mol,H2(g)+1/2O2(g)==H2O(g);△H =-241KJ/mol,由以上反应推断往炽热的炉膛内通入水蒸气时
A.不能节省燃料,但能使炉火瞬间更旺 B.虽不能使炉火瞬间更旺,但可以节省燃料
C.既能使炉火瞬间更旺又可以节省燃料 D.既不能使炉火瞬间更旺,又不能节省燃料
难度: 中等查看答案及解析
-
根据热化学方程式(101 KPa) S(s) +O2 (g)=SO2 (g); △H=-297.23KJ/mol分析下列说法不正确的是
A.S的燃烧热为297.23KJ/mol
B.S(g) +O2 (g)=SO2 (g) 放出的热量大于297.23KJ
C.S(g) +O2 (g)=SO2 (g) 放出的热量小于297.23KJ
D.形成1molSO2化学键所释放总能量大于断裂1molS(s)和1molO2(g)的化学键所吸收的总能量
难度: 简单查看答案及解析
-
少量铁粉与100mL 0.01mol/L的稀盐酸反应,反应速率太慢.为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加CH3COONa固体
⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发)
⑧改用10mL 0.1mol/L盐酸.
A.①⑥⑦ B.③⑤⑧ C.③⑦⑧ D.⑤⑦⑧
难度: 简单查看答案及解析
-
短周期元素W、X、Y、Z的原子序数依次增大,W与Y、X与Z位于同一主族,W与X可形成共价化合物WX2,Y原子的内层电子总数是其最外层电子数的2.5倍。下 列 叙述中不正确的是
A.WX2、WZ2分子中所有原子最外层都为8电子结构
B.WX2、ZX2的化学键类型和晶体类型都相同
C.X的氢化物的熔沸点比Z的氢化物的熔沸点高
D.原子半径大小顺序为X<W<Y<Z
难度: 简单查看答案及解析
-
下列图示与对应的叙述相符的是( )

A.图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图2表示常温下,等量锌粉与足量的等浓度的盐酸反应(滴加CuSO4溶液的为虚线)
C.图3表示KNO3的溶解度曲线,a点所示的溶液是80℃时KNO3的不饱和溶液
D.图4表示某可逆反应生成物的量随反应时间变化的曲线,t时反应物转化率最大
难度: 简单查看答案及解析
-
可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极。下列说法正确的是
A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-=4OH-
B.以NaOH溶液为电解液时,负极反应为:Al+3OH--3e-=Al(OH)3↓
C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变
D.电池工作时,电子通过外电路从正极流向负极
难度: 简单查看答案及解析
-
右图为一原电池的结构示意图,下列说法不正确的是
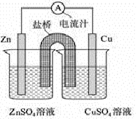
A.原电池工作时的总反应为Zn+Cu2+=Zn2++Cu,该反应一定为放热反应
B.原电池工作时,Zn电极流出电子,发生氧化反应
C.原电池工作时,铜电极上发生氧化反应,CuSO4溶液蓝色变深
D.如果将Cu电极改为Fe电极,Zn电极依然作负极
难度: 简单查看答案及解析