-
已知在周期表中第118号元素位于周期表的第七周期0族,预测第114号元素的下列叙述中,错误的是( )
A.位于周期表的第七周期第ⅣA族 B.原子的最外层有4个电子
C.肯定是非金属元素 D.常见的化合价有+2和+4价
难度: 中等查看答案及解析
-
低合金高强度钢Q460是支撑“鸟巢”的铁骨钢筋,除含有铁元素外,还含有Mn(锰)、Ti(钛)、Cr(铬)、Nb(铌)等合金元素,下列有关说法正确的是( )
A.Fe位于元素周期表的第四周期、第ⅧB族
B.工业上利用热还原法冶炼金属Fe、Cr、Mn
C.
TiO2、
TiO2、
TiO2互为同位素
D.
Nb3+原子核内有51个中子,核外有41个电子
难度: 中等查看答案及解析
-
下表是部分短周期元素的原子半径及主要化合价,根据表中信息,判断以下叙述正确的是( )

A.L2+、R2-的核外电子数相等
B.单质与浓度相等的稀盐酸反应的速率为Q>L
C.氢化物的稳定性:H2T<H2R
D.M与T形成的化合物既能与强酸反应又能与强碱反应
难度: 中等查看答案及解析
-
下列实验不能达到预期目的的是()

难度: 中等查看答案及解析
-
化学能与热能、电能等可以相互转化,关于化学能与其它能量相互转化的说法正确的是()
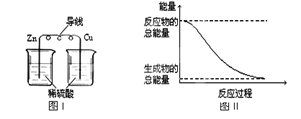
A.图I所示的装置能将化学能转变为电能
B.图II所示的反应为吸热反应
C.中和反应中, 反应物的总能量比生成物的总能量低
D.化学反应中能量变化的主要原因是化学键的断裂与生成
难度: 中等查看答案及解析
-
两种气态的烷烃的混合物在标准状况下密度为1.16g/L,则对此混合物组成的说法正确的是
A.一定没有甲烷
B.一定没有乙烷
C.可能是甲烷和戊烷的混合物
D.可能是乙烷和丙烷的混合物
难度: 中等查看答案及解析
-
下列物质中,含有非极性键的共价化合物是()
A.Na2O2 B.CH3CH3 C.NaCl D.N2
难度: 中等查看答案及解析
-
反应A+B→C(放热)分两步进行:①A+B→X(吸热),②X→C(放热)。下列示意图中,能正确表示总反应过程中能量变化的是()

难度: 中等查看答案及解析
-
已知氢化铵(NH4H)与氯化铵的结构相似,又知NH4H与水反应有H2生成,下列有关叙述中不正确的是()
①NH4H是离子化合物,含有离子键和共价键 ②NH4H溶于水所形成的溶液显酸性
③NH4H与水反应时,NH4H是氧化剂 ④NH4H固体投入少量的水中,有两种气体产生
A.①② B.②③ C.①②③ D.全部
难度: 中等查看答案及解析
-
下列关于酒精的叙述错误的是()
A.化学名称为乙醇
B.易挥发
C.常用作有机溶剂
D.不能被酸性高锰酸钾氧化
难度: 简单查看答案及解析
-
下列关于苯的叙述正确的是( )

A.反应①为取代反应,有机产物的密度比水小
B.反应②为氧化反应,反应现象是火焰明亮并带有较多的黑烟
C.反应③为取代反应,有机产物是一种烃
D.反应④1mol苯最多与3molH2发生加成反应,是因为苯分子含有三个碳碳双键
难度: 中等查看答案及解析
-
近来科学家研制了一种新型的乙醇电池(DEFC),它用磺酸类质子作溶剂,在200 ℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更加安全。电池总反应式为C2H5OH+3O2===2CO2+3H2O,下列说法不正确的是( )
A.C2H5OH在电池的负极上参加反应
B.在外电路中电子由负极沿导线流向正极
C. 1 mol乙醇被氧化转移6 mol电子
D.电池正极得电子的物质是O2
难度: 中等查看答案及解析
-
烯烃在一定条件下发生氧化反应,碳碳双键断裂,如:R1CH===CHR2,被氧化为
 被氧化为
被氧化为 ,由此推断分子式为C4H8的烯烃在该条件下的氧化产物有
,由此推断分子式为C4H8的烯烃在该条件下的氧化产物有A.2种 B.3种
C.4种 D.6种
难度: 中等查看答案及解析
-
下图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图,下列说法正确的是()
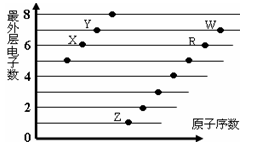
A.X和R在同一周期
B.原子半径:W>R>X
C.气态氢化物的稳定性:Y>X
D.X、Z形成的化合物中只有离子键
难度: 中等查看答案及解析
-
镁燃料电池具有比能量高、使用方便、原材料来源丰富、成本低等特点。一般研究的镁燃料电池可分为镁空气燃料电池、镁海水燃料电池、镁过氧化氢燃料电池和镁次氯酸盐燃料电池。其中,镁次氯酸盐燃料电池的工作原理如图所示,下列有关说法不正确的是( )

A.镁燃料电池中镁均为负极,发生氧化反应
B.镁次氯酸盐燃料电池的总反应式为Mg+ClO-+H2O=Mg(OH)2+Cl-
C.镁过氧化氢燃料电池,酸性电解质中正极反应式为H2O2+2H++2e-=2H2O
D.镁次氯酸盐燃料电池放电过程中OH-移向正极
难度: 中等查看答案及解析
-
在乙烯、乙醛(C2H4O)组成的混合物中,氢元素的质量分数是9%,则氧元素的质量分数为()
A.16% B.37% C.48% D.无法计算
难度: 中等查看答案及解析
-
四川有丰富的天然气资源。天然气的主要成分是甲烷,还含有一定量的乙烷、丙烷等可燃性气体。下列有关说法不正确的是()
A.甲烷与丙烷互为同系物
B.甲烷是烃类物质中氢的质量分数最高的化合物
C.甲烷、乙烷、丙烷中的化学键都是极性共价键
D.乙烷和氯气在光照的条件下可发生取代反应,生成多种氯代烃
难度: 中等查看答案及解析
-
对于密闭容器中的反应:N2(g)+3H2(g)
2NH3(g),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是( )

A.点a的正反应速率比点b的小
B.点c处反应达到平衡
C.点d (t1时刻)和点e (t2时刻)处n (N2)不一样
D.其他条件不变,773K下反应至t1时刻,n(H2)比图中d点的值大
难度: 中等查看答案及解析
-
结构简式为
 的有机物在一定条件下能和氢气完全加成,加成产物的一溴代物有(不考虑-OH的取代)()
的有机物在一定条件下能和氢气完全加成,加成产物的一溴代物有(不考虑-OH的取代)()A.4种 B.5种 C.6种 D.7种
难度: 中等查看答案及解析
-
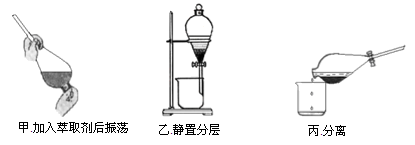
实验室里有200mLCH3COOCH2CH3,经检验,发现其中溶有少量CH3COOH,如果要除去这些CH3COOH,请选择下列中的有效方法()
A.蒸馏
B.水洗后分液
C.用过量饱和Na2CO3溶液洗涤后分液
D.用过量NaCl溶液洗涤后分液
难度: 中等查看答案及解析
-
将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)
2NH3(g)+CO2(g)。不能判断该分解反应已经达到化学平衡的是
A.密闭容器中二氧化碳的体积分数不变
B.密闭容器中气体的总物质的量不变
C.密闭容器中混合气体的密度不变
D.v(NH3)正 =2 v(CO2)逆
难度: 中等查看答案及解析
-
下列反应中能检验尿液中存在葡萄糖的是()
A.加金属钠,看是否有氢气放出
B.与新制的Cu(OH)2悬浊液混合煮沸,观察有无红色沉淀生成
C.与醋酸和浓硫酸共热,看能否发生酯化反应
D.加入饱和碳酸钠溶液中看是否分层
难度: 中等查看答案及解析
-
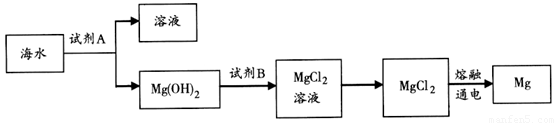
随着世界人口的急剧增长和工业的快速发展,淡水供应危机日益成为世界关注的焦点,海水约占地球现有总水量的97%,海水淡化问题已成为科学家的主要研究方向,若实行海水淡化来供应饮用水,下列方法在原理上完全不可行的是
A.加入明矾,使海水的盐份沉淀并淡化
B.利用太阳能,将海水蒸馏淡化
C.将海水通过离子交换树脂,以除去所含的盐分
D.利用半透膜,采用反渗透法而使海水淡化
难度: 简单查看答案及解析
-
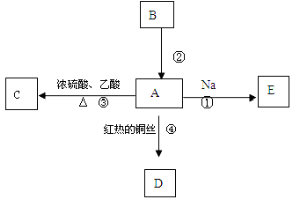
利用金属活性的不同,可以采取不同的冶炼方法冶炼金属。下列反应所描述的冶炼方法不可能实现的是( )
A.2Al2O3(熔融)
4Al+3O2↑
B.Fe2O3+3CO
2Fe+3CO2
C.Fe+CuSO4 ===FeSO4+Cu
D.2NaCl(水溶液)
2Na+Cl2↑
难度: 中等查看答案及解析
-
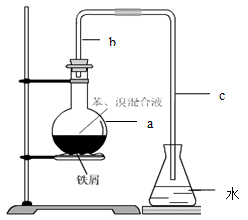
取一只大试管,通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气,用铁架台固定好。放在光亮处一段时间,下列对观察到的现象的描述及说明正确的是( )
A.试管中气体颜色变浅,是因为发生了加成反应
B.试管中有少量白雾生成,这是氯化氢的小液滴
C.试管内壁出现油状液体,这是甲烷与氯气的混合溶液
D.试管内壁出现油状液体,这是CH3Cl小液滴
难度: 中等查看答案及解析
-
在塑料袋中放一个成熟的苹果,再放些青香蕉,将袋口密封。两天后,发现青香蕉成熟了。导致青香蕉成熟的物质是成熟苹果释放出的
A.C6H6 B.CH3COOH C.C2H4 D.CH3CH2OH
难度: 简单查看答案及解析
-
a、b、c、d、e为元素周期表前3周期中的部分元素,它们在元素周期表中的相对位置如图所示。下列叙述正确的是( )
A.b元素除0价外,只有一种化合价
B.五种元素中,c元素的性质最稳定
C.d气态氢化物溶于水,溶液显碱性
D.e元素最高价氧化物对应的水化物和不同量的氢氧化钠反应,可能生成三种盐
难度: 中等查看答案及解析
-
诗句“春蚕到死丝方尽,蜡炬成灰泪始干”中丝和泪分别指( )
A.纤维素 油脂 B.蛋白质 烃类 C.淀粉 油脂 D.蛋白质 油脂
难度: 简单查看答案及解析
-
苹果酸是一种常见的有机酸,其结构简式如下图。苹果酸可能发生的反应是( )
①与NaOH溶液反应 ②使石蕊溶液变红 ③与金属钠反应放出气体
④一定条件下与乙酸发生酯化反应 ⑤一定条件下与乙醇发生酯化反应
A.①②③ B.①②③④ C.①②③⑤ D.①②③④⑤
难度: 中等查看答案及解析
-
已知:①1mol某链烃最多能与1molHCl发生加成反应,生成1mol氯代烷;②1mol该氯代烷能与7molCl2发生取代反应,生成只含碳、氯的氯代烷。该烃可能是( )
A.CH3CH=CH2 B.CH2=CHCH=CH3 C.CH3CH=CHCH3 D.CH2=CH2
难度: 中等查看答案及解析