-
2011年是国际化学年,我国举行了以“化学——我们的生活,我们的未来……”为主题的系列活动。下列说法中不正确的是( )
A.使用“无磷洗涤剂”,促进水体富营养化
B.研发易降解的塑料,防止白色污染
C.回收处理工业废气,减少大气污染
D.安装煤炭“固硫”装置,降低酸雨发生率
难度: 简单查看答案及解析
-
下列说法不正确的是( )
A.浓硝酸与足量铜片反应时,先生成红棕色气体,后生成无色气体
B.浓硫酸具有强氧化性,常温下可将铁、铝的单质氧化
C.饱和氯水既有酸性又有漂白性,加入NaHCO₃后漂白性减弱
D.浓盐酸与足量二氧化锰反应后,盐酸有剩余
难度: 中等查看答案及解析
-
分类是化学研究中常用的方法,下列分类方法中,正确的是( )
A.NO2、SiO2、CO均为酸性氧化物
B.稀豆浆、硅酸、氯化铁溶液均为胶体
C.氨、冰醋酸、烧碱均为电解质
D.福尔马林、水玻璃、氯水均为混合物
难度: 中等查看答案及解析
-
下列物质与其用途完全符合的有几条( )
①Na2CO3—制玻璃;②MgO—耐火材料;③AgI—人工降雨;④NaCl—制纯碱;⑤Al2O3—焊接钢轨;⑥NaClO—消毒剂;
A.3 B.4 C.5 D.6
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是( )
A.氯化钡溶液中通入二氧化碳气体:Ba2++CO2+H2O=BaCO3↓+2H+
B.次氯酸钙溶液中通人少量SO2气体:Ca2++2ClO一+SO2+H2O=CaSO3↓+2HClO
C.醋酸和碳酸氢钠溶液混合:CH3COOH+HCO3-=CO2↑+H2O+CH3COO-
D.碳酸氢镁溶液中加入过量石灰水:
Mg2++2HCO
+Ca2++2OH-=CaCO3↓+2H2O+MgCO3↓
难度: 中等查看答案及解析
-
X、Y、Z是原子序数依次增大且属于不同周期的三种常见短周期元素,三种元素相互之间可以形成1:1型的化合物M、N、R,常温下M、N为固体,R为液体.M、N遇到水都能产生气体,而且产生的气体相互可以化合,下列说法正确的是( )
A.三种元素都是非金属元素
B.M、N投入水中所得溶液中溶质相同
C.三种化合物都是共价化合物
D.Z是地壳中含量最多的元素
难度: 困难查看答案及解析
-
设NA代表阿伏加德罗常数的数值,下列说法中正确的是( )
①常温常压下,17 g重甲基(-14CD3)所含的中子数为11NA;
②常温常压下,22.4 L NO气体的分子数小于NA;
③64 g铜发生氧化还原反应,一定失去2NA个电子;
④室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA;
⑤1 mol铁铝混合物与足量稀盐酸反应时,转移电子数是3 NA;
⑥常温常压下,1 mol氦气含有的核外电子数为4NA;
⑦6.8g熔融的KHSO4中含有的阳离子数为0.05 NA ;
A.①② B.③④⑦ C.②④⑦ D.②⑤⑥
难度: 困难查看答案及解析
-
下列依据热化学方程式得出的结论正确的是( )
A.已知2H2(g)+O2(g)=2H2O(g);△H=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1
B.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H=-57.3 kJ·mol-1
则含40.0g NaOH的稀溶液与稀醋酸完全中和,放出57.3kJ的热量
C.已知C(石墨,s)=C(金刚石,s);△H>0,则石墨比金刚石稳定
D.己知2C(s)+2O2(g)=2CO2(g));△H=a、2C(s)+O2(g)=2CO(g);△H=b,则a>b
难度: 中等查看答案及解析
-
下列有关实验操作的叙述正确的是( )
A.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
B.某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性
C.NaCl 溶液蒸发结晶时,蒸发皿中刚好有晶体析出时即停止加热
D.向AlCl3溶液中滴加氨水,会产生白色沉淀,再加入NaHSO4溶液,沉淀不消失
难度: 中等查看答案及解析
-
某研究性学习小组为了探索镁粉与溴水反应的机理,做了如下四组实验:
①将镁粉投入冷水中,未见任何现象;
②将镁粉放入溴水中,观察到只是开始时产生极少量的气泡,但溴水的颜色逐渐褪去;
③将镁粉放入液溴中,未观察到任何明显现象;
④向含足量镁粉的液溴中滴加几滴水,观察到溴的红棕色很快褪去。
则下列关于镁与溴水的反应机理论述中正确的是( )
A.镁粉只直接与溴水中的溴反应
B.镁粉只与溴水中的酸反应
C.产生极少量的气泡是由于镁粉与水反应得到
D.镁粉在水的催化下与溴发生反应
难度: 中等查看答案及解析
-
由于碘是卤素中原子半径较大的元素,可能呈现金属性。下列事实最能够说明这个结论的是 ( )
A.已经制得了 IBr、ICl 等卤素互化物
B.已经制得 I2O5 等碘的氧化物
C.已经制得了I (NO3)3、I (ClO4)3·2H2O等含 I3+ 离子化合物
D.碘(I2)易溶于KI等碘化物溶液,形成I3- 离子
难度: 中等查看答案及解析
-
现有一块已知质量的铝镁合金,欲测定其中镁的质量分数,几位同学设计了以下三种不同的实验方案
实验设计1:铝镁合金
测定生成的气体在标准状况下的体积
实验设计2:铝镁合金
测定生成的气体在标准状况下的体积
实验设计3:铝镁合金
溶液
过滤,测定得到沉淀的质量
则能测定出镁的质量分数的是( )
A.都能B.都不能C.①不能,其它都能 D.②③不能,①能
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A、原子晶体中,共价键的键能越大,熔沸点越高
B、分子晶体中,分子间作用力越大,该分子越稳定
C、分子晶体中,共价键键能越大,熔沸点越高
D、某晶体溶于水中,可电离出自由移动的离子,该晶体一定是离子晶体
难度: 中等查看答案及解析
-
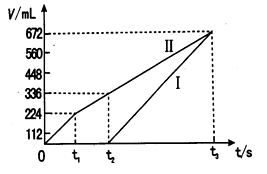
向盛有一定量的Ba(OH)2的溶液中逐滴加入稀硫酸,直至过量,整个过程中混合溶液的导电能力(用电流强度I表示),近似地用如下图曲线表示,应为( )
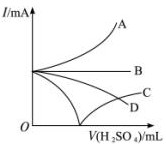
难度: 中等查看答案及解析
-
已知298K时,2SO2(g)+O2(g)
2SO3(g);△H=-197KJ/mol。在相同的温度和压强下,向密闭容器中通入2molSO2和1molO2,达到平衡时放出热量Q1,向另一个体积相同的容器中通入1molSO2、0.5molO2和1molSO3,达到平衡时放出热量Q2。则下列关系式正确的是( )
A、Q1=Q2=197KJ B、Q1<Q2<197KJ C、Q2<Q1<197KJ D、Q1=Q2<197KJ
难度: 中等查看答案及解析
-
已知:Cu+2Fe3+=Cu2++2Fe2+;Zn+2Fe3+=2Fe2++Zn2+。现将等物质的量的CuSO4、FeCl3和Zn于水中充分反应,所得混合物中除了SO42―、Cl―外,还含有( )
A、Zn2+、Fe3+、Cu B、Cu2+、Fe3+、Zn
C、Zn2+、Cu2+、Fe2+、Fe D、Zn2+、Fe2+、Cu2+、Cu
难度: 中等查看答案及解析
-
在反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,1molCuSO4能氧化磷的物质的量是( )
A、
mol B、
mol C、
mol D、
mol
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
A.1 molCl2与足量Fe反应转移电子数一定为3NA
B.标准状况下,2.24 L NH3中含有共价键的数目为NA
C.1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3 NA
D.标况下,11.2 L HF所含的分子数目为0.5NA
难度: 中等查看答案及解析
-
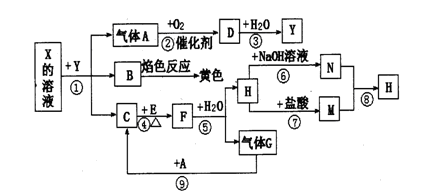
某同学为检验溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得到的正确结论是( )

A.原溶液中一定含有SO42-离子 B.原溶液中一定含有NH4+离子
C.原溶液中一定含有Cl-离子 D.原溶液中一定含有Fe3+离子
难度: 中等查看答案及解析
-
将51.2gCu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8mol,这些气体恰好能被500ml 2mol/LNaOH溶液完全吸收,生成含NaNO3和NaNO2的盐溶液,则原混合气体中NO的物质的量为 ( )
A.0.3mol B.0.4mol C.0.5mol D. 0.6mol
难度: 中等查看答案及解析
-
(1)已知:① TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1
②2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
写出TiO2和焦炭、氯气反应生成液态TiCl4和CO气体的热化学方程式:________________。
(2)有一类甲醇质子交换膜燃料电池,需将甲醇蒸气转化为氢气,两种反应原理是:
A.CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
B.CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-676.7 kJ·mol-1
由上述方程式可知,CH3OH的标准燃烧热________(填“大于”“等于”“小于”或“不能确定”)-676.7 kJ·mol-1。已知水的气化热为44 kJ·mol-1,则氢气燃烧的热化学方程式为__________________________。
难度: 中等查看答案及解析