-
化学与人类生产、生活和社会可持续发展密切相关。下列说法不正确的是
A. 光化学烟雾是氮氧化物受紫外线照射后与空气中的一些碳氢化合物作用后生成的一种有毒烟雾
B. “煤改气”、“煤改电”等清洁燃料改造工程有利于减少雾霾天气
C. 绿色化学的核心是应用化学原理对环境污染进行治理
D. 航天飞机上使用的隔热陶瓷瓦,大多是以碳纤维做增强体的新型复合材料
难度: 简单查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列判断正确的是
A. 常温下,pH=1的盐酸溶液中,由水电离的H+个数为10-13NA
B. 标准状况下,氧原子总数为0.2NA的CO2和NO2的混合气体,其体积为2.24L
C. 常温下,5.6g铁分别与足量氯气和浓硝酸反应,转移的电子数目均为0.3NA
D. 100g46%(质量分数)乙醇溶液中所含O-H数目为7NA
难度: 中等查看答案及解析
-
分子式为C5H9ClO2的有机物,能与NaHCO3溶液反应生成气体,则符合此条件的结构(不考虑立体异构)有
A. 9种 B. 10种 C. 11种 D. 12种
难度: 中等查看答案及解析
-
辉铜矿(主要成分是Cu2S)是冶炼铜的主要原料,辉铜矿样品的纯度可以用酸性高锰酸钾溶液滴定来测定,该反应可表示为Cu2S+
+H+→Cu2++
+Mn2++H2O(未配平)。下列说法中不正确的是
A. Cu2S为还原剂被氧化,
为氧化剂被还原
B. 氧化剂和还原剂物质的量之比为2∶1
C. 反应中每消耗1 mol Cu2S,转移8 mol电子
D. 滴定时可以不加其他的指示剂
难度: 中等查看答案及解析
-
常温下,电解质溶液中的下列关系式不正确的是
A. 已知A-+H2B(过量)
HA+HB-,则结合H+的能力:HB-<A-<B2-
B. 在0.1 mol·L-1的氨水中滴加0.1 mol·L-1盐酸,恰好完全中和时溶液的pH=a,则由水电离产生的c(OH-)=10-a mol·L-1
C. 将c mol·L-1的醋酸溶液与0.02 mol·L-1NaOH溶液等体积混合后溶液恰好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=
D. 将0.2 mol·L-1盐酸与0.1 mol·L-1的KAlO2溶液等体积混合,溶液中离子浓度由大到小的顺序:c(Cl-)>c(K+)>c(Al3+)>c(H+)>c(OH-)
难度: 困难查看答案及解析
-
下图中甲为甲烷和O2构成的燃料电池示意图,电解质为KOH溶液,乙为电解饱和MgCl2溶液的装置,其中乙装置中X为阳离子交换膜。用该装置进行实验,反应开始后观察到Fe电极附近出现白色沉淀。下列说法正确的是
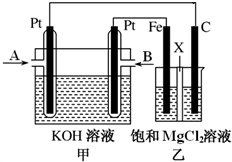
A. 甲中A处通入CH4,电极反应式为CH4+10OH--8e-===
+7H2O
B. 乙中电解MgCl2溶液的总反应为2Cl-+2H2O
Cl2↑+H2↑+2OH-
C. 理论上甲中每消耗22.4 L CH4(标准状况下),乙中产生4 mol Cl2
D. 甲、乙中电解质溶液的pH都增大
难度: 中等查看答案及解析
-
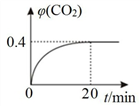
温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,发生反应:
PCl5(g)=====PCl3(g)+Cl2(g) △H=akJ/mol(a>0)
0~10min保持容器温度不变,10min时改变一种条件,整个过程中PCl5、PCl3、Cl2的物质的量随时间的变化如图所示。下列说法正确的是

A. 0~4min的平均速率v(Cl2)=0.05mol/(L·min )
B. 10min时改变的条件是分离出一定量的PCl5
C. 起始时向该容器中充入2.0mol PCl3和2.0molCl2,保持温度为T,反应达平衡时放出的热量大于1.6akJ
D. 温度为T,起始时向该容器中充入1.0mol PCl5、0.10mol PCl3和0.10molCl2,反应达到平衡前,v(正)>v(逆)
难度: 困难查看答案及解析




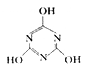 +3H2O。
+3H2O。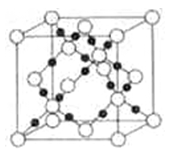
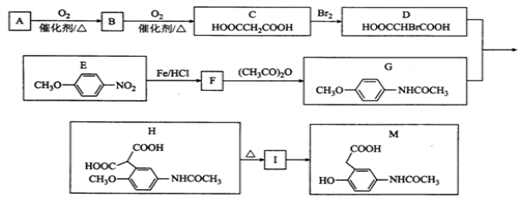

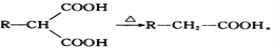
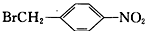 为原料(无机试剂任选),设计制备
为原料(无机试剂任选),设计制备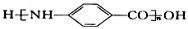 的合成路线:_______________________________________________。
的合成路线:_______________________________________________。