-
下列有关甲醛的化学用语表达错误的是
A.结构简式:HCHO B.最简式:CH2O
C.比例模型:
D.电子式:
难度: 中等查看答案及解析
-
下列有关物质性质和应用的因果关系正确的是
A.二氧化锰具有强氧化性,能将双氧水氧化为氧气
B.浓硫酸具有较强酸性,能使Cu转化为Cu2+
C.炭具有还原性,一定条件下能将二氧化硅还原为硅
D.二氧化硫具有漂白性,所以与氯水混合使用效果更好
难度: 中等查看答案及解析
-
下列物质的制备,符合工业生产实际的是
A.电解饱和氯化钠溶液制备金属钠
B.将氨气与二氧化碳先后通入饱和食盐水中,生成碳酸氢钠沉淀,再生成纯碱
C.将氢气和氯气混合后点燃,产物用浓盐酸吸收制备盐酸
D.将SO2和O2 的混合气加压后,通过接触室制备SO3
难度: 中等查看答案及解析
-
用普通圆底烧瓶将某卤化钠和浓硫酸加热至500℃制备纯净HX气体,则该卤化钠是
A.NaF B.NaCl C.NaBr D.NaI
难度: 中等查看答案及解析
-
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如下图所示。常温下,S2Cl2遇水易与水发生反应,并产生能使品红褪色的气体。下列说法错误的是
A.S2Cl2的结构式为Cl-S-S-Cl
B.若S2Br2与S2Cl2结构相似,则熔沸点:S2Br2>S2Cl2
C.S2Cl2为含有极性键和非极性键的非极性分子
D.S2Cl2与H2O反应的化学方程式可能为: 2S2Cl2 + 2H2O → SO2↑ + 3S↓ + 4HCl
难度: 困难查看答案及解析
-
某溶液中含有HCO3-、SO32-、SO42-、Cl-和Na+,若向其中通入Cl2,溶液中离子浓度增大的是
A.HCO3- B.SO42- C.SO32- D.OH-
难度: 中等查看答案及解析
-
下列叙述错误的是
A.硝酸银溶液通常保存在棕色试剂瓶中,因为硝酸银见光易分解
B.乙醇的沸点比甲醚(CH3—O—CH3)高,主要原因是乙醇分子间作用力更大
C.反应AgCl + Br- → AgBr + Cl-能在水溶液中进行,是因为AgBr比AgCl更难溶于水
D.常温下浓硫酸可贮存在铁制或铝制容器中,说明常温下铁和铝与浓硫酸不反应
难度: 中等查看答案及解析
-
已知NaCN溶液呈碱性;(CN)2与卤素单质的性质相似;CN-的还原性介于Br-、I-之间。下列变化不能发生的是
A.HCN
H++CN- B.(CN)2 + CH2=CH2 → NC—CH2—CH2—CN
C.(CN)2+2Br-→ 2CN-+Br2 D.(CN)2 + 2OH-→ CN- + CNO- + H2O
难度: 中等查看答案及解析
-
将导出H2S气体的导管点燃后伸入盛有一定量O2的集气瓶内,下列3个反应发生的先后顺序是
① 2H2S + O2 → 2S + 2H2O ② 2H2S + SO2 → 3S + 2H2O ③ 2H2S + 3O2 → 2SO2 + 2H2O
A.①②③ B.③①② C.①③② D. ③②①
难度: 中等查看答案及解析
-
三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3 。则下列说法错误的是
A.反应过程中,被氧化与被还原的元素的物质的量之比为1:2
B.NF3是一种无色、无臭的气体,因此NF3在空气中泄漏时不易被察觉
C.若反应中转移的电子数目为6.02×1023,则可生成22.4L NO气体(标准状况)
D.一旦NF3泄漏,可以用石灰水溶液喷淋的方法减少污染
难度: 中等查看答案及解析
-
某一化学反应在不同条件下的能量变化曲线如图所示。下列说法正确的是

A.化学催化比酶催化的效果好
B.使用不同催化剂可以改变反应的热效应
C.使用不同催化剂可以改变反应的能耗
D.反应物的总能量低于生成物的总能量
难度: 中等查看答案及解析
-
异秦皮啶具有镇静安神抗肿瘤功效,秦皮素具有抗痢疾杆菌功效。它们在一定条件下可发生转化,如图所示。有关说法正确的是
A.异秦皮啶与秦皮素互为同系物
B.异秦皮啶分子式为C11H12O5
C.秦皮素一定条件下能发生加成反应、消除反应和取代反应
D.1mol秦皮素最多可与2molBr2、4molNaOH反应
难度: 中等查看答案及解析
-
从碘的四氯化碳溶液中除去碘以回收四氯化碳,下列操作最简便的是
A.向其中放入过量镁条,反应完毕后取出
B.蒸馏
C.加入能氧化I2的KMnO4,再分液
D.通入氯气
难度: 中等查看答案及解析
-
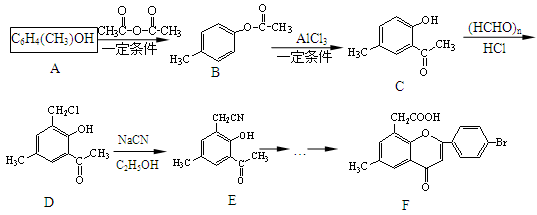
实验装置如图所示。下列说法正确的是

A.该装置不能发生原电池反应
B.活性炭是阴极
C.总反应为:4Al+3O2 +6H2O → 4Al(OH)3
D.电子从铝箔流出,经电流表、活性炭、滤纸回到铝箔
难度: 中等查看答案及解析
-
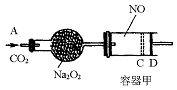
关于下列各实验装置图的叙述中,错误的是
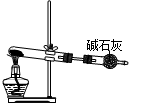
A.①可用于分离苯和溴苯的混合物 B.①可用于分离乙酸和乙醇的混合物
C.②可用于分解NH4Cl制备NH3 D.②可用于Ca(OH)2与NH4Cl共热制备NH3
难度: 中等查看答案及解析
-
硼酸(H3BO3)溶液中存在如下反应:H3BO3(aq)+H2O(l)
[B(OH)4] –(aq)+H+(aq)。
化学式
电离常数(298K)
硼酸
K=5.7×10-10
碳酸
Ki1=4.4×10-7
Ki2=4.7×10-11
醋酸
K=1.75×10-5
下列说法一定正确的是
A.碳酸钠溶液滴入硼酸中能观察到有气泡产生
B.醋酸滴入碳酸钠溶液中能观察到有气泡产生
C.等物质的量浓度的碳酸溶液和硼酸溶液比较,pH:前者>后者
D.等物质的量浓度的碳酸钠溶液和醋酸钠溶液比较,pH:前者>后者
难度: 中等查看答案及解析
-
1L稀硝酸和稀硫酸的混合溶液,其溶质的物质的量浓度分别为0.1mol/L 和0.2mol/L。若向该混合溶液中加入足量的铜粉。则最多能溶解铜粉的质量为
A.2.4 g B.3.2 g C.6.4 g D.9.6 g
难度: 中等查看答案及解析
-
将氯化铵固体溶解在D2O(重水)中,反应的离子方程式正确的是
A.NH4+ + D2O
NH3·D2O + H+ B.NH4+ + D2O
NH3·HDO + D+
C.NH4+ + 2D2O
NH3·HDO + D3O+ D.NH4+ + 2D2O
NH3·D2O + HD2O+
难度: 中等查看答案及解析
-
已知2Al+2NaOH+2H2O
2NaAlO2+3H2。该反应中有关物理量的描述正确的是(NA表示阿伏加德罗常数)
A.每生成0.3 mol H2,被还原的水分子数目为0.6 NA
B.当有2.7 g Al参加反应时,转移的电子数目为0.3 NA
C.每生成6.72 L的H2,溶液中AlO2-的数目就增加0.2 NA
D.溶液中每增加0.1 mol的AlO2-,Na+的数目就增加0.1 NA
难度: 中等查看答案及解析
-
已知NO2遇水发生反应:2NO2 + H2O → HNO2 + HNO3。实验证明将NO2通入水中会逸出NO气体,而通入NaOH溶液中则可完全被吸收,通入Na2CO3溶液中只逸出CO2。下列说法错误的是
A.HNO2非常不稳定,其分解产物为NO和H2O
B.NO2与水的反应机理:NO2先与水发生岐化反应生成HNO2和HNO3,HNO2再分解
C.HNO2的酸性弱于碳酸的酸性
D.NO2通入NaOH溶液中,生成的HNO2和HNO3都与NaOH发生中和反应
难度: 中等查看答案及解析
-
常温下,0.1 mol/L氨水溶液中
=1×10-8,下列叙述错误的是
A.该溶液中氢离子的浓度:c(H+ ) = 1×10-9 mol/L
B.0.1 mol/L 氨水溶液与0.1 mol/L HCl溶液等体积混合后所得溶液中:
c(NH4+ ) + c(H+ ) = c(Cl- ) + c(OH-)
C.0.1 mol/L 的氨水溶液与0.05 mol/L H2SO4溶液等体积混合后所得溶液中:
c(NH4+ ) + c(NH3) + c(NH3·H2O) = 2c(SO42-)
D.浓度均为0.1 mol/L 的NH3·H2O和NH4Cl溶液等体积混合后,若溶液呈碱性,则
c(NH4+ )> c (NH3·H2O) > c(Cl-) > c(OH-) > c(H+ )
难度: 困难查看答案及解析
-
含MgCl2、AlCl3均为n mol的混合溶液,向其中滴NaOH溶液至过量。加入NaOH的物质的量与生成沉淀的物质的量的关系正确的是(离子(或物质)沉淀pH见右表)
离子
Mg2+
Al 3+
物质
Al(OH)3
开始沉淀pH
8.93
3.56
开始溶解pH
8.04
完全沉淀pH
10.92
4.89
完全溶解pH
12.04
难度: 中等查看答案及解析