-
接触法制硫酸中,进入接触室的气体必须净化、干燥,其主要原因是( )
A.防止催化剂中毒 B.提高反应效率
C.提高SO2转化率 D.防止环境污染
难度: 简单查看答案及解析
-
下列有关燃料的说法错误的是( )
A.燃料燃烧产物CO2是温室气体之一
B.化石燃料完全燃烧不会造成大气污染
C.以液化石油气代替燃油可减少大气污染
D.燃料不完全燃烧排放的CO是大气污染物之一
难度: 简单查看答案及解析
-
下列说法不符合生产实际的是( )
A.硫酸生产中,SO2催化氧化选择1~10 MPa、400~500 ℃条件下进行
B.尾气中含有少量SO2,可用石灰水吸收,然后再用硫酸处理
C.工业上,通常采用以铁为主的催化剂,在400~500 ℃和10~30 MPa的条件下合成氨
D.造气中产
生的CO,可在催化剂作用下,与水蒸气反应生成CO2和H2
难度: 中等查看答案及解析
-
2SO2(g)+O2(g)
2SO3(g)是制备硫酸的重要反应。下列叙述正确的是( )
A.催化剂V2O5不改变该反应的逆反应速率
B.增大反应体系的压强,反应速率一定增大
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间
D.在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为v=
难度: 困难查看答案及解析
-
以下关于氨碱法与联合制碱法的认识,不正确的是( )
A.氨碱法生产纯碱的原料便宜易得,步骤简单,是最早的制碱工艺
B.联合制碱法又称侯氏制碱法,是侯德榜在氨碱法的基础上改造形成的
C.在联合制碱法中,氯化钠的利用率比氨碱法中的高
D.联合制碱法避免了氨碱法中对氯化钙的处理
难度: 中等查看答案及解析
-
某条件下,在2L密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。
下列有关说法不正确的是( )
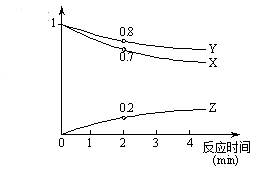
A.反应2min末X的浓度为0.35mol/L
B.该反应的化学方程式可表示为:2Z⇋2Y+3X
C.反应2min内以Z浓度变化表示的平均反应速率为0.05mol/(L•min)
D.任何时刻以Z、Y浓度变化表示的反应速率关系符合υ(Z)=υ(Y)
难度: 中等查看答案及解析
-
25℃、101 kPa下,1g氢气燃烧生成液态水,放出142.9kJ热量,能表示H2燃烧热的热化学方程式为( )
A.2H2(g)+O2(g)==2H2O(1) △H=―571.6kJ/mol
B.2H2(g)+O2(g)==2H2O(1) △H=+571.6kJ/mol
C.H2(g)+
O2(g)==H2O(g) △H=―285.8kJ/mol
D.H2(g)+
O2(g)==H2O(1) △H=―285.8kJ/mol
难度: 中等查看答案及解析
-
下列观点正确的是( )
A.催化剂是影响化学反应速率的主要因素 B.化学反应的反应热与反应途径无关
C.增大压强一定能增大化学反应速率 D.反应物分子间发生碰撞即可发生化学反应
难度: 中等查看答案及解析
-
在恒温、恒容下发生反应:A(s)+B(g) = C(g)+D(g) △H<0。则下列判断正确的是( )
A.向该容器中加入少量A,反应速率增大
B.向该容器中充入氩气,反应速率增大
C.将粉末状A代替块状A能加快反应
D.该反应为放热反应,无需加热即可发生
难度: 中等查看答案及解析
-
下列各组热化学方程式中,△H1>△H2的是( )
A.C(s)+O2(g)==CO2(g) △H1 C(s)+
O2(g)==CO(g) △H2
B.S(s)+O2(g)==SO2(g) △H1 S(g)+O2(g)==SO2(g) △H2
C.2H2(g)+O2(g)== 2H2O(l) △H1 2H2(g)+O2(g)== 2H2O(g) △H2
D.CaCO3(s)==CaO(s)+CO2(g) △H1 CaO(s)+H2O(l)==Ca(OH)2(s) △H2
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.增大反应物浓度能增大有效碰撞的几率
B.增加压强能增大反应物活化分子的百分数
C.增加反应物浓度能增大反应物活化分子的百分数
D.分解反应都是吸热反应
难度: 中等查看答案及解析
-
生产液晶显示器的过程中使用的化学清洗剂NF3是
一种温室气体,其存储能量的能力是CO2的12000~20000倍,在大气中的寿命可长达740年之久,以下是几种化学键的键能:
化学键
N≡N
F—F
N—F
键能:kJ/mol
941.7
154.8
283.0
下列说法中正确的是( )
A.过程N2(g)
2N(g)放出能量
B.过程N(g)+3F(g)
NF3(g)放出能量
C.反应N2(g)+3F2(g)
2NF3(g)的ΔH>0
D.NF3吸收能量后如果没有化学键的断裂与生成,仍能可能发生化学反应
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.1 mol H2SO4与 1 mol Ba(OH)2完全反应放出的热量叫做中和热
B.等物质的量强酸和弱酸分别与等量的烧碱反应生成等量的水,弱酸反应放出的热量比强酸少
C.CO能继续与O2反应生成稳定的氧化物CO2,所以说CO与O2的反应
是吸热反应
D.在101 kPa时,1 mol C燃烧时放出的热量为C的燃烧热
难度: 中等查看答案及解析
-
以下是表示反应2A+B=3C+4D的反应速率数据。按照反应快慢顺序排列应为( )
①υ(A)=0.5mol·L-1·S-1 ②υ(B)=0.3mol·L-1·S-1
③υ(C
)=0.8mol·L-1·S-1 ④υ(
D)=1mol·L-1·S-1
A.④>③>①>② B.②>③>①=④ C.②>③>①>④ D.③>②>①=④
难度: 中等查看答案及解析
-
在一定条件下,充分燃烧一定量的丁烷放出热量Q kJ(Q>0),经测定完全吸收生成的CO2需消耗 5 mol·L-1 KOH溶液100 mL,恰好生成正盐,则此条件下反应C4H10(g)+13/2O2(g)= 4CO2(g)+5H2O(g)的ΔH为( )
A.+8 Q kJ·mol-1 B.+16 Q kJ·mol-1
C.-8 Q kJ·mol-1 D.-16 Q kJ·mol-1
难度: 困难查看答案及解析
-
已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1
H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是( )
A.H2(g)的燃烧热为571.6kJ·mol-1
B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C.1/2H2SO4(aq)+1/2Ba(OH)2(aq)=1/2BaSO4(s)+H2O(l)ΔH=-57.3kJ·mol-1
D.3H2(g)+CO2(g)=CH3OH(l)+H2O(l)ΔH=+135.9kJ·mol-1
难度: 困难查看答案及解析
-
对于反应mA+nB===pC,下列说法正确的是( )
A.某温度时,化学反应速率无论用A、B、C何种物质表示,其数值是相同的
B.其他条件不变,增大压强,反应速率加快
C.若增加或减小B的物质的量,则反应速率一定会发生明显的变化
D.其他条件不变,升高温度,反应速率加快
难度: 中等查看答案及解析
-
已知A(g)+B(g)=C(g) ΔH1,D(g)+B(g)=E(g) ΔH2。若A和D混合气体1 mol与B完全反应,反应热为ΔH3,则A和D物质的量之比为( )
A.(ΔH2-ΔH3)/(ΔH1-ΔH3) B.(ΔH3-ΔH2)/(ΔH1-ΔH3)
C.(ΔH3-ΔH2)/(ΔH3-ΔH1) D.(ΔH1-ΔH3)/(ΔH3-ΔH1)
难度: 中等查看答案及解析
-
(已知:2SO2(g)+O2(g)
2SO3(g)△H=-196.6KJ·mol-1),恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图所示。以下叙述错误的是( )
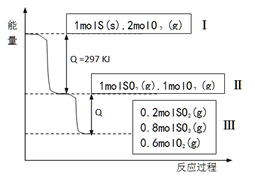
A.表示硫的燃烧热的热化学方程式:S(s)+O2(g)==SO2(g)ΔH=-297KJ·mol-1
B.由Ⅱ到Ⅲ的过程放出的热量为98.3KJ
C.恒温恒容时,1molSO2和2molO2充分反应,放出热量的数值大于78.64KJ
D.将Ⅲ中的混合气体通入足量的NaOH溶液中消耗NaOH的物质的量为2mol
难度: 中等查看答案及解析
-
已知: P4(g)+6Cl2(g)=4PCl3(g) △H=a kJmol-1
P4(g)+10Cl2(g)=4PCl5(g) △H=b kJmol-1
P4具有正四面体结构,PCl5中P-Cl键的键能为c kJmol-1,PCl3中P-Cl键的键能为1.2c kJmol-1。 下列叙述正确的是 ( )
A.P-P键的键能大于P-Cl键的键能
B.可求Cl2(g)+ PCl3(g)==4PCl5(s)的反应热△H
C.Cl-Cl键的键能为(b-a+5.6c)/4 kJmol-1
D.P-P键的键能为(5a-3b+12c)/8 kJmol-1
难度: 困难查看答案及解析