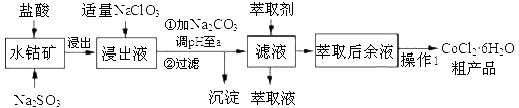
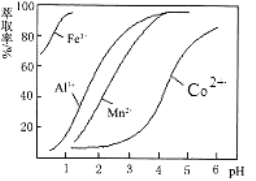
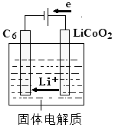
-
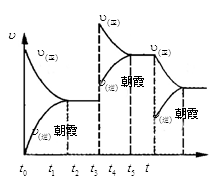
下列叙述正确的是( )
A.汽油、柴油和植物油都属于烃
B.乙醇既能被氧化为乙醛,也能被氧化为乙酸
C.苯与溴水在Fe3+催化下发生取代反应生成溴苯
D.硫酸铜溶液和硫酸铵溶液均可使蛋白质溶液变性
难度: 简单查看答案及解析
-
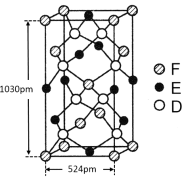
下列说法正确的是( )
A.共价化合物中可能含有离子键
B.Ca2+、K+、Cl-、S2-四种粒子的离子半径依次减小
C.
Po、
Po、
Po三种原子的核外电子数分别为124、125、126
D.第ⅥA族元素氧、硫、硒对应的氢化物H2O、H2S、H2Se的稳定性依次减弱
难度: 中等查看答案及解析
-
有机物X、Y、M的转化关系为:
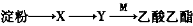 ,下列说法错误的是( )
,下列说法错误的是( ) A.X可用新制的氢氧化铜检验 B.Y有同分异构体
C.M含有两种碳氧共价键 D.Y可发生加成反应
难度: 简单查看答案及解析
-
下列实验中,所采取的分离方法与对应原理都正确的是 ( )
选项
目的
分离方法
原理
A.
分离氢氧化铁胶体和氯离子
盐析
胶体不能透过半透膜,离子能
B.
分离植物油和水的混合物
分液
二者互不相溶且密度不同
C.
除去苏打中少量小苏打
加热
二者的溶解度不同
D.
除去乙醇中的乙酸
蒸馏
乙醇与乙酸沸点相差较大
难度: 简单查看答案及解析
-
已知pH表示溶液中c(H+)的负对数,同样也可以定义pOH表示溶液中c(OH-)的负对数,即pOH=-lg(OH-),温度T时水的离子积常数用KW表示,则此温度下不能判定溶液呈中性的依据是( )
A.
=1 B.pOH=
C.c(H+)=10-pOH D.pH+pOH=
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.0.1 mol·L-1Na2S溶液中含有的Na+离子数为0.2NA
B.50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA
C.标准状况下,22.4 L以任意比例混合的氢气和氯气混合气中含有的原子总数为2NA
D.0.10 mol Fe粉与足量水蒸气反应生成的H2分子数为0.10NA
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.在pH=1的溶液中:K+、Na+、SO42–、HCO3-
B.在0.1 mol·L-1 Na2CO3溶液中:Al3+、K+、NO3-、SO42–
C.在0.1 mol·L-1 FeCl3溶液中:K+、NH4+、I-、SCN-
D.在c( H+)/c(OH-)=10-12的溶液中:K+、Na+、ClO-、NO3-
难度: 中等查看答案及解析
-
下列有关物质的性质和该性质的应用均正确的是( )
A.SiO2具有较好的导电性,可用于制造半导体材料
B.H2O2是一种绿色氧化剂,可氧化酸性高锰酸钾而产生O2
C.铜的金属活动性比铁弱,可用铜罐代替铁罐贮运浓硝酸
D.Mg在空气中燃烧发出耀眼的白光,可用于制作信号弹
难度: 简单查看答案及解析
-
A~D是含同一元素的四种物质,它们相互之间有如图所示的转化关系,其中A是单质,D是氢氧化物,则A可能是( )
①Al ②Mg ③Fe ④Na
A.①③ B.①②③ C.①② D.②③④
难度: 困难查看答案及解析
-
下列事实中,能说明氯的非金属性比硫强的是( )
①HClO的氧化性比H2SO4的氧化性强 ②常温下氯气是气态而硫是固态
③盐酸酸性比氢硫酸强 ④HCl比H2S稳定 ⑤H2S能被Cl2氧化成硫
⑥SCl2分子中氯显-1价 ⑦氯气与氢气化合比硫与氢气化合要容易进行
⑧Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS
A.①②③④⑤⑥⑦⑧ B.①④⑤⑥⑦
C.④⑤⑥⑦⑧ D.③④⑤⑦⑧
难度: 简单查看答案及解析
-
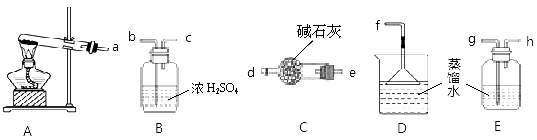
下列实验设计方法正确的是( )

A.向卤代烃加硝酸酸化的硝酸银来检验其中的卤族素元素
B.实验用NH4Cl固体受热分解来制备NH3
C.用盐酸和澄清石灰水来检验某物质是否含有CO32-
D.可用下图所示的装置和药品来研究反应物浓度对反应速率的影响
难度: 简单查看答案及解析
-
下列说法或表达正确的是( )
①活性炭、SO2和HClO都具有漂白作用,且漂白的化学原理相同
②向100 mL0.1 mol/L 的溴化亚铁溶液中通入0.05 mol的氯气时发生反应的离子方程式:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
③斜长石KAlSi3O8的氧化物形式可表示为:K2O•Al2O3•3SiO2
④酸性条件下KIO3溶液与KI溶液发生反应生成I2时的离子方程式:
IO3-+5I-+3H2O=I2+6OH-
⑤碳酸氢根离子的电离方程式可表示为:
⑥元素周期表中,从上到下,卤族元素的非金属性逐渐减弱,氢卤酸的酸性依次减弱
⑦500℃、30MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)
2NH3(g) △H= 38.6 kJ·mol-1
A.全部 B.②⑤ C.②③④⑦ D.②④⑦
难度: 中等查看答案及解析
-
阿司匹林是日常生活中应用广泛的医药之一。它可由下列方法合成:
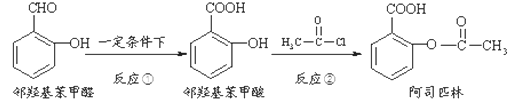
下列说法正确的是( )
A.邻羟基苯甲醛分子中所有的原子不可能在同一平面
B.用酸性KMnO4溶液直接氧化邻羟基苯甲醛可实现反应①
C.反应②中加入过量的NaHCO3有利提高阿司匹林的产率
D.与邻羟基苯甲酸互为同分异构体,苯环上一氯代物仅有2种且能发生银镜反应的酚类化合物共有3种
难度: 简单查看答案及解析
-
某溶液中可能含有以下6种离子中的几种:NH4+、A13+、Mg2+、CO32―、Cl一、SO42―,为确认溶液组成,现取100 mL分成三等份溶液进行如下实验:
(1)向第一份溶液中加入 AgNO3溶液有沉淀产生;
(2)向第二份溶液中加入足量NaOH溶液充分反应后,最终得到沉淀0.58 g,同时收集到气体0.03 mol(设气体全部从溶液中逸出);
(3)向第三份溶液中加入足量BaCl2溶液(盐酸酸化)充分反应后,得到沉淀6.99 g。由此可知,下列关于原溶液组成的正确结论是( )
A.一定存在Cl一 B.溶液中含有A13+和NH4+
C.一定不存在Mg2+,可能存在A13+ D.溶液中SO42―的浓度是0.03 mol/L
难度: 中等查看答案及解析
-
右图是研究铁钉腐蚀的装置图,下列说法不正确的是
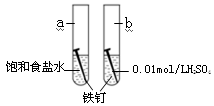
A.铁钉在两处的腐蚀速率:a < b
B.a、b两处铁钉中碳均正极
C.a、b两处铁钉中的铁均失电子被氧化
D.a、b两处的正极反应式均为O2+4e-+4H+ ===2H2O
难度: 简单查看答案及解析
-
有一块铁的“氧化物”样品,用140mL 5.0mol·L-1 盐酸恰好将之完全溶解,所得溶液还能吸收0.025mol Cl2,恰好使其中的Fe2+全部转变为Fe3+,则该样品可能的化学式为( )
A.Fe2O3 B.Fe3O4 C.Fe4O5 D.Fe5O7
难度: 中等查看答案及解析
-
下列说法中正确的是 ( )
① 钠在空气中燃烧生成淡黄色的Na2O2 ② 常温下铝制容器可储运浓硫酸或浓硝酸③ 盐酸既有氧化性又有还原性④ Fe(OH)3、FeCl2、H2SiO3都不能直接用化合反应制备⑤ SO2能使酸性高锰酸钾溶液褪色,所以它具有漂白性
A.②③ B.①②③ C.①②③④ D.①②③⑤
难度: 中等查看答案及解析
-
下列离子方程式表达正确的是( )
A.过氧化钠和水反应:2Na2O2+2H2O=4Na++4OH—+O2↑
B.用铜为电极电解饱和食盐水:2Cl—+2H2O===Cl2↑+H2↑+2OH—
C.在明矾溶液中滴加过量氨水:Al3++3OH—=Al(OH)3↓
D.向小苏打溶液中加少量Ba(OH)2溶液:HCO3—+Ba2++OH—=BaCO3↓+H2O
难度: 中等查看答案及解析
-
Q、W、X、Y、Z是原子序数依次增大的短周期元素,X的焰色反应呈黄色。Q元素的原子最外层电子数是其内层电子数的2倍。W、Z最外层电子数相同,Z的核电荷数是W的2倍。元素Y的合金是日常生活中使用广泛的金属材料之一,下列说法正确的是( )
A.氢化物稳定性:Z>W
B.原子半径的大小顺序:rX>rW>rQ>rY
C.元素Q和Z能形成QZ2型的共价化合物
D.X、Y的最高价氧化物的水化物之间不能发生反应
难度: 中等查看答案及解析
-
将11.2gFe投入浓硝酸溶液,产生红棕色气体A,把所得溶液减压蒸干,得到40gFe (NO3)2和Fe(NO3)3的混合物,将该固体在密闭容器中高温加热,得到红褐色的Fe2O3和气体B,A、B气体混合通入足量水中,在标准状况下剩余气体的体积为 ( )
A.2240mL B.4480mL C.3360mL D.1120mL
难度: 中等查看答案及解析