-
下列对化学反应的认识,错误的是( )
A.会引起化学键的变化
B.会产生新物质
C.必然引起物质状态的变化
D.必然伴随着能量的变化难度: 中等查看答案及解析
-
下列关于有机物的说法,正确的是( )
A.苯不能使KMnO4溶液褪色,因此苯不能发生氧化反应
B.油脂、乙醇是人体必需的营养物质
C.CH3CH2OH与CH3CHO是同分异构体
D.用饱和Na2CO3溶液可以除去乙酸乙酯中混有的少量乙酸和乙醇难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数,下列有关说法正确的是( )
A.20g重水(2H2O)含有10NA个电子
B.常温常压下,22.4L氦气含有NA个氦原子
C.1mol乙酸和1mol乙醇在浓硫酸加热条件下反应,可生成NA个乙酸乙酯分子
D.在pH=13的NaOH溶液中,OH-的数目为0.1NA难度: 中等查看答案及解析
-
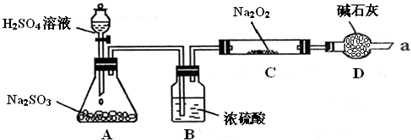
下列气体制备装置错误的是( )
A.
用氢氧化钙与氯化铵制取氨气
B.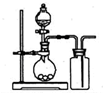
用氢氧化钠与浓氨水制取氨气
C.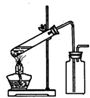
用铜与浓硫酸制取二氧化硫
D.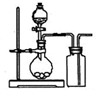
用铜与稀硝酸制取一氧化氮难度: 中等查看答案及解析
-
下列溶液中,各组离子一定能够大量共存的是( )
A.无色溶液中:K+、H+、SO42-、MnO4-
B.的溶液中:K+、Na+、CO32-、[Al(OH)4]-
C.能使pH试纸变蓝色的溶液中:Ca2+、Na+、CO32-、SO42-
D.含有大量Fe3+的溶液中:H+、Mg2+、I-、SCN-难度: 中等查看答案及解析
-
近年来,科学家研制了一种新型的乙醇电池,它用酸性电解质(H+)作溶剂.电池总反应为:C2H5OH+3O2=2CO2+3H2O,下列说法不正确的是( )
A.乙醇在电池的负极上参加反应
B.1mol CH3CH2OH被氧化转移6mol电子
C.在外电路中电子由负极沿导线流向正极
D.电池正极的电极反应为4H++O2+4e-→2H2O难度: 中等查看答案及解析
-
今有室温下四种溶液,有关叙述正确的是( )
① ② ③ ④ pH 11 11 3 3 溶液 氨水 氢氧化钠溶液 醋酸 盐酸
A.①、②中分别加入适量的氯化铵晶体后,①溶液的pH减小;②溶液的pH不变
B.温度下降10℃,①、②、③、④四种溶液的pH均不变
C.分别加水稀释10倍,四种溶液的pH:①>②>④>③
D.①、④两溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(H+)>c(OH-)难度: 中等查看答案及解析