-
应对能源危机的有效途径之一就是寻找新能源.下列属于新能源的是( )
A.煤 B. 石油 C. 太阳能 D. 天然气
难度: 简单查看答案及解析
-
下列物质的水溶液,不存在电解质分子的是(水分子除外)( )
A.HCl B. CH3COOH C. NH3 D. HF
难度: 简单查看答案及解析
-
关于吸热反应的说法,正确的是( )
A.凡需加热的反应一定是吸热反应
B.只有分解反应才是吸热反应
C.吸热反应一定不能自发进行
D.盐类的水解反应是吸热反应
难度: 简单查看答案及解析
-
已知在K2Cr2O7的溶液中存在着如下平衡:Cr2O72﹣(橙色)+H2O⇌2CrO42﹣(黄色)+2H+,加入下列物质能使溶液变为橙色的是( )
A. 氨水 B. 硫酸 C. NaOH D. 水
难度: 简单查看答案及解析
-
下列过程需要通电才能进行的是( )
①电离 ②电解 ③电镀 ④电泳 ⑤电化学腐蚀
A.①②③ B.②④⑤ C.②③④ D.全部
难度: 简单查看答案及解析
-
下列说法错误的是( )
A.反应产物的总焓与反应物的总焓之差,称为反应焓变
B.反应产物的总焓小于反应物的总焓,该反应为放热反应
C.同一反应在不同温度下进行,其焓变是不同的
D.已知2NO2(g)═N2O4(g)△H1,N2O4(g)═2NO2(g)△H2,则△H1=﹣△H2
难度: 中等查看答案及解析
-
某可逆反应当正反应速率增大时,下列说法正确的是( )
A.逆反应速率一定增大 B.平衡一定向正反应方向进行
C.反应物的转化率一定增大 D.该反应的条件一定发生变化
难度: 简单查看答案及解析
-
下列关于氯化铵溶液的说法正确的是( )
A.升高温度,氯化铵水解程度增大
B.水解平衡向右移动,溶液的pH一定减小
C.向溶液中加入氯化钠固体,能抑制氯化铵的电离
D.向溶液中加入氯化铵固体,水解平衡向右移动,水解程度增大
难度: 中等查看答案及解析
-
用惰性电极电解下列溶液的说法正确是( )
A.电解氯化钾溶液的过程中,溶液的pH变小
B.电解硝酸银溶液的过程中,阴极质量不变,阳极质量增大
C.电解硫酸钠溶液的过程中,两极产生气体的物质的量不相同
D.电解氢氧化钠溶液的过程中,氢氧化钠的物质的量浓度减小
难度: 中等查看答案及解析
-
在下列给定条件的溶液中,一定能大量共存的离子组是( )
A.无色溶液中:K+、Fe2+、Cl﹣、NO3﹣
B.含有大量Fe3+的溶液:Na+、Mg2+、NO3﹣、SCN﹣
C.pH=12的溶液中:K+、NH4+、SO42﹣、NO3﹣
D.水电离产生的c(OH﹣)=1×10﹣14mol•L﹣1:K+、Na+、Cl﹣、NO3﹣
难度: 中等查看答案及解析
-
为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂,过滤后,再向过滤中加入适量的盐酸,这种试剂是( )
A.NH3.H2O B. NaOH C. Na2CO3 D. MgCO3
难度: 中等查看答案及解析
-
下列溶液,按pH由小到大顺序排列的是( )
①0.1mol/L HCl溶液②0.1mol/L H2SO4溶液③0.1mol/L NaOH溶液④0.1mol/L CH3COOH溶液.
A. ①②④③ B. ②①④③ C. ③④①② D. ④③②①
难度: 中等查看答案及解析
-
下列离子方程式属于水解的是( )
A.HCO3﹣+H2O H3O++CO32﹣ B.CH3COO﹣+H3O+ CH3COOH+H2O
C.HS﹣+H2O H2S+OH﹣ D.NH4++OH﹣ NH3•H2O
难度: 简单查看答案及解析
-
一定条件下,在恒容密闭容器中,能表示反应X(g)+2Y(g) 2Z(g)一定达到化学平衡状态的是( )
A.容器中的压强不再发生变化
B.X、Y、Z的物质的量之比为1:2:2
C.X、Y、Z的速率之比1:2:2
D.单位时间内生成n mol Z,同时消耗n mol Y
难度: 中等查看答案及解析
-
用标准的盐酸滴定未知浓度的NaOH溶液,下列操作不会引起实验误差的是( )
A.用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定
B.用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,后装入NaOH溶液进行滴定
C.用碱式滴定管取10.00 mL NaOH溶液放入用蒸馏水洗净的锥形瓶中,再加入适量蒸馏水进行滴定
D.用酚酞作指示剂滴至红色刚变无色时即停止加盐酸
难度: 困难查看答案及解析
-
下列说法中,正确的是( )
A.活化分子间的碰撞一定是有效碰撞
B.其他条件相同时,增大反应物浓度,反应物中活化分子的百分数增加
C.焓变和熵变都与反应的自发性有关,它们都能独立地作为自发性的判据
D.常温下,FeCl3溶液中由水电离出的c (H+)一定大于1×10﹣7mol/L
难度: 中等查看答案及解析
-
下列水解反应的应用,不正确的是( )
A.CO32﹣+H2O HCO3﹣+OH﹣ 热的纯碱溶液清洗油污
B.Al3++3H2O Al(OH)3 (胶体)+3 H+ 明矾净水
C.TiCl4+(x+2)H2O(过量) TiO2•x H2O+4HCl 用TiCl4制备TiO2
D.SnCl2+H2O Sn(OH)Cl+HCl 配制氯化亚锡溶液时应加入氢氧化钠
难度: 中等查看答案及解析
-
已知:2NO2 N2O4△H<0,CaO溶于水放热,NH4Cl晶体溶于水吸热.在3个体积相等的圆底烧瓶中充满等量的NO2气体,并分别放置在加有下列物质的烧杯(烧杯内有水)中:(1)中加入CaO,(2)中加入NH4Cl晶体,(3)中不加任何其它物质,如图所示.下列叙述正确的是( )

A.(1)中红综色变深,(2)中红棕色变浅
B.(1)中红综色变浅,(2)中红棕色变深
C.烧瓶(1)中气体的压强不变
D.烧瓶(2)中气体的压强增大
难度: 中等查看答案及解析
-
关于电解NaCl水溶液,下列叙述正确的是
A.电解时在阳极得到氯气,在阴极得到金属钠
B.若在阳极附近的溶液中滴入KI试液,溶液呈棕色
C.若在阴极附近的溶液中滴入酚酞试液,溶液呈无色
D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
难度: 中等查看答案及解析
-
与纯水的电离相似,液氨中也存在着微弱的电离:2NH3 NH4++NH2﹣,据此判断以下叙述中不正确的是( )
A.液氨中含有NH3、NH4+、NH2﹣微粒
B.其他条件不变,若增加液氨的量,电离平衡将正向移动
C.只要不加入其他物质,液氨中c(NH4+)=c(NH2﹣)
D.一定温度下液氨中c(NH4+)•c(NH2﹣)是一个常数
难度: 中等查看答案及解析
-
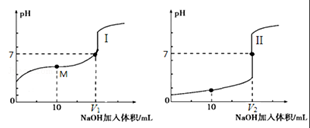
有等体积、等pH的Ca(OH)2、KOH和NH3•H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是( )
A. V3>V2>V1 B. V3=V2=V1 C. V3>V2=V1 D. V1=V2>V3
难度: 中等查看答案及解析
-
铅蓄电池的电池反应为:Pb(s)+PbO2(s)+2H2SO4(aq)
2PbSO4(s)+2H2O.下列说法正确的是( )
A. 放电时,正极的反应式是:PbO2+SO42﹣+4H++2e﹣═PbSO4+2H2O
B. 放电时,电解质溶液中的H+向负极移动
C. 充电时,阳极的电极反应为:PbSO4+2e﹣═Pb(s)+SO42﹣
D. 充电时,当有20.7gPb生成时,转移的电子为0.1mol
难度: 中等查看答案及解析
-
将浓度为0.1 mol·L-1 HF溶液加水不断稀释,下列各量始终保持增大的是( )
A.c(H+) B.Ka(HF) C.
D.
难度: 中等查看答案及解析
-
下列有关热化学方程式的叙述正确的是( )
A.2H2(g)+O2(g)===2H2O(g) ΔH=+483.6 kJ/mol
B.已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定
C.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应的热化学方程式为: NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l) ΔH=-57.4 kJ/mol
D.己知2C(s)+2O2(g)==2CO2(g) ΔH1 2C(s)+O2(g)==2CO(g) ΔH2,则ΔH1>ΔH2
难度: 中等查看答案及解析
-
右图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是
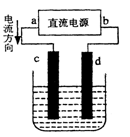
A.a为负极、b为正极
B.a为阳极、b为阴极
C.电解过程中,氯离子浓度不变
D.电解过程中,d电极质量增加
难度: 中等查看答案及解析