-
下列关于有机物说法正确的是

A.乙醇、乙烷和乙酸都可以与钠反应生成氢气
B.石油分馏可获得乙酸、甲烷、苯等
C.苯和乙烯都可以使溴的四氯化碳溶液褪色
D.上海世博会永久性标志建筑之一——上海世博轴的上层巨型膜结构ETFE由单体乙烯和四氟乙烯
加聚而成

难度: 简单查看答案及解析
-
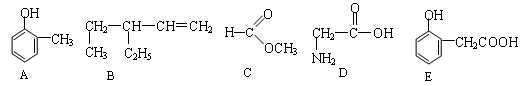
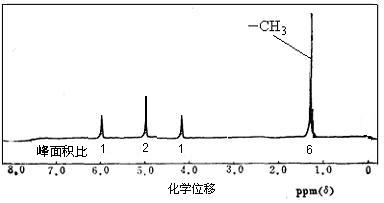
下列分子式表示的物质一定是纯净物的是
A.C5H10 B.C2H4O2 C.CH4O D.C2H4Cl2[来
难度: 简单查看答案及解析
-
以下各组物质可以用分液漏斗分离的是
A.硝基苯和水 B.乙醇和水
C.甲醛和水 D.乙酸乙酯和乙酸
难度: 简单查看答案及解析
-
北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开。S-诱抗素的分子结构如右图,下列关于该物质的说法正确的是
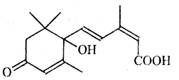
A.其分子式为C15H22O4
B.1 mol该物质与NaOH溶液反应,最多消耗2 molNaOH
C.既能发生加聚反应,又能发生缩聚反应
D.既可以与FeCl3溶液发生显色反应,又可以使酸性KMnO4溶液褪色
难度: 简单查看答案及解析
-
单斜硫和正交硫转化为二氧化硫的能量变化图如右图,下列说法正确的是

A.S(s,单斜) = S(s,正交) △H =+0.33kJ·mol -1
B.正交硫比单斜硫稳定
C.相同物质的量的正交硫比单斜硫所含有的能量高
D.①表示断裂lmol O2中的共价键所吸收的能量比形成1mol SO2中的共价键所放出的能量少297.16kJ
难度: 简单查看答案及解析
-
已知如下物质的溶度积常数:Ksp(FeS)=6.3×10-18mol2·L-2; Ksp(CuS)=1.3×10-36mol2·L-2。下列说法正确的是
A.同温度下,CuS的溶解度大于FeS的溶解度
B.同温度下,向饱和FeS溶液中加入少量Na2S固体后,Ksp(FeS)变小
C.向含有等物质的量的FeCl2和CuCl2的混合溶液中逐滴加入Na2S溶液,最先出现的沉淀是FeS
D.除去工业废水中的Cu2+,可以选用FeS做沉淀剂
难度: 简单查看答案及解析
-
某温度下,NaCl溶液中c(H+)=10-6 mol·L-1。该温度下,1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,则该碱溶液的pH等于
A.9.0 B.9.5 C.8.5 D.10.5
难度: 简单查看答案及解析
-
在密闭容器中,对于可逆反应:A+3B
2C(气)平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是
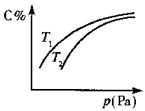
A.若正反应方向△H<0,则T1>T2
B.压强增大时,混合气体的平均相对分子质量减小
C.B一定气体
D.A一定为气体
难度: 简单查看答案及解析
-
分子式与苯丙氨酸
相同,且同时符合下列两个条件:①含有两个取代基的苯环②有一个硝基直接连在苯环上,这样的同分异构体数目有
A.3个 B.5个 C.10个 D.6个
难度: 简单查看答案及解析
-
下列涉及有机物的性质或应用的说法不正确的是
A.蛋白酶是蛋白质,它不仅可以催化蛋白质的水解反应,还可催化淀粉的水解反应科
B.用大米酿的酒在一定条件下密封保存,时间越长越香醇
C.油脂在碱的催化作用下可发生水解,工业上利用该反应生产肥皂
D.溴乙烷在热的NaOH水溶液中主要发生消去反应
难度: 简单查看答案及解析
-
下列实验方案可行的是
A.比较碳酸和苯酚的酸性强弱:用浓醋酸和Na2CO3反应,产生的气体直接通入苯酚钠溶液中,看是否有浑浊出现
B.证明CH2=CHCH2CHO 中有碳碳不饱和键:滴入KMnO4酸性溶液,看紫红色是否褪去
C.检验淀粉水解产物中有葡糖糖:取少量水解液,加入适量氢氧化钠中和,再向其中滴加新制Cu(OH)2悬浊液,加热,观察现象
D.配制新制Cu(OH)2浊液:向2mL10%NaOH溶液中加入5滴的2%CuSO4溶液
难度: 简单查看答案及解析
-
每年的6月26日是国际禁毒日,珍爱生命,远离毒品。以下是四种毒品的结构简式,下列有关说法正确的是
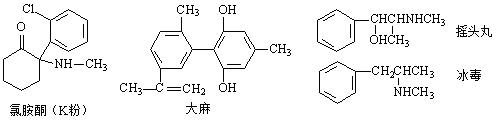
A.四种毒品都属于芳香族化合物,都难溶于水
B.摇头丸经消去、加成反应可制取冰毒82615205
C.1mol大麻与溴水反应最多消耗4mol Br2
D.大麻分子中所有碳原子不可能共平面
难度: 简单查看答案及解析
-
对于体积相同的①
、②)NH4Cl、③H2SO4溶液,下列说法正确的是
A.溶液的pH相同时,3种溶液物质的量浓度大小顺序是③>②>①
B.溶液的pH相同时,由水电离出的c(H+)大小顺序是②=①>③
C.溶液的pH相同时,将3种溶液稀释相同倍数,pH变化最大的是①
D.①中 c(NH4+)< 2c(SO42-)
难度: 简单查看答案及解析
-
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g)
2NH3(g) △H=-92.6 kJ/moL。实验测得起始、平衡时的有关数据如下表:
容器编号[
起始时各物质物质的量/mol
达平衡时体系能量的变化
N2
H2
NH3
①
1
3
0
放出热量:23.15kJ
②
0.9
2.7
0.2
放出热量:Q
下列叙述正确的是
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数相等
C.容器②中达平衡时放出的热量Q=23.15 kJ
D.达到平衡时容器②中N2的转化率为40%
难度: 简单查看答案及解析