-
下列对于“摩尔”的理解正确的是( )
A.摩尔是国际科学界建议采用的一种物理量
B.摩尔是物质的量的单位,简称摩,符号为mol
C.摩尔可以把物质的宏观数量与微观粒子的数量联系起来
D.国际上规定,0.012 kg碳原子所含有的碳原子数目为1 mol难度: 中等查看答案及解析
-
下列物质属于纯净物的是( )
A.漂白粉
B.液氯
C.氯水
D.磷在氯气中燃烧产物难度: 中等查看答案及解析
-
电解饱和食盐水,不能直接得到的物质是( )
A.氢气
B.氯气
C.氢氧化钠
D.氯化氢难度: 中等查看答案及解析
-
饱和氯水长期放置后,下列微粒数目在溶液中增多的是( )
A.Cl2
B.HClO
C.Cl-
D.H2O难度: 中等查看答案及解析
-
下列说法中,正确的是( )
A.CO2的摩尔质量为44 g
B.标准状况下,1 mol CO2所占的体积约是22.4 L
C.1 mol N2的质量是14 g
D.将40 g NaOH溶于1 L水中,所得溶液中NaOH的物质的量浓度为1 mol/L难度: 中等查看答案及解析
-
易与
反应,形成离子化合物的是( )
A.
B.
C.
D.难度: 中等查看答案及解析
-
标准状况下:①5.4mlH2O ②5.6LCH4 ③3.01×1023个HBr分子 ④19.6gH2SO4,这些物质中,所含原子个数最多的是( )
A.④
B.③
C.②
D.①难度: 中等查看答案及解析
-
同温同压下,两种气体的体积如果不相同,其主要原因是( )
A.气体的分子大小不同
B.气体分子间的平均距离不同
C.气体的性质不同
D.气体的分子数不同难度: 中等查看答案及解析
-
下列物质中,只有共价键的是( )
A.NaCl
B.KOH
C.H2O
D.NH4Cl难度: 中等查看答案及解析
-
卤族元素随核电荷数的增加,下列叙述正确的是( )
A.单质的颜色逐渐变浅
B.气态氢化物的稳定性逐渐减弱
C.单质的熔点逐渐降低
D.单质的氧化性逐渐增强难度: 中等查看答案及解析
-
取100mL 0.3mol•L-1和300mL 0.25mol•L-1的硫酸注入500mL的容量瓶中,加水稀释至刻度线,该混合溶液中H+的物质的量浓度是( )
A.0.21 mol•L-1
B.0.56 mol•L-1
C.0.42 mol•L-1
D.0.26 mol•L-1难度: 中等查看答案及解析
-
在一定温度和压强下,4体积A2(气)与6体积B2(气)化合生成4体积C(气)(气体体积在相同状况下测得),则C的化学式为( )
A.AB3
B.AB2
C.A2B3
D.A2B难度: 中等查看答案及解析
-
容量瓶上需标有:①容量 ②刻度线 ③温度 ④压强 ⑤浓度 ⑥酸式或 碱式等项中的( )
A.①②③
B.①③⑤
C.②④⑥
D.③⑤⑥难度: 中等查看答案及解析
-
将潮湿的Cl2通过甲装置后,再通过放有干燥红色布条的乙装置,红色布条不褪色.则甲装置中所盛试剂可能是( )
①浓硫酸 ②NaOH溶液 ③KI溶液 ④饱和食盐水.
A.①
B.②③
C.①②③
D.②③④难度: 中等查看答案及解析
-
下列关于氯的说法正确的是( )
A.Cl2具有很强的氧化性,只能做氧化剂
B.、
为氯元素的两种同位素,化学性质不同
C.1.12L Cl2含有1.7NA个质子(NA 表示阿伏伽德罗常数)
D.实验室制备Cl2,可用排饱和食盐水集气法收集难度: 中等查看答案及解析
-
向含20.6gNaBr的溶液中通入Cl2后,将溶液蒸干,得固体16.15g,下列说法正确的是( )
A.反应的Cl2为0.05mol
B.40%的Br-被氧化
C.NaBr全部转化为NaCl
D.16.15g固体由NaCl和Br2组成难度: 中等查看答案及解析
-
鉴别Cl-、Br-、I-可以选用的试剂有( )
A.碘水、淀粉溶液
B.氯水、四氯化碳
C.氯水、碘化钾淀粉溶液
D.硝酸银溶液、稀硝酸难度: 中等查看答案及解析
-
如图所示各种尾气吸收装置中,适合于吸收HCl气体,而且能防止倒吸的是( )
A.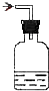
B.
C.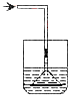
D.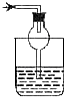
难度: 中等查看答案及解析
-
已知反应:①Cl2+2KBr→2KCl+Br2,②KClO3+6HCl(浓)→3Cl2↑+KCl+3H2O,③2KBrO3+Cl2→Br2+2KClO3,下列说法正确的是( )
A.上述三个反应都是置换反应
B.氧化性由强到弱的顺序为KBrO3>KClO3>Cl2>Br2
C.反应②中若得到6.72L Cl2(STP),则电子转移个数为3.01×1023
D.③中1mol氧化剂参加反应得到电子的物质的量为2mol难度: 中等查看答案及解析
-
某K2CO3样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质中的一种或二种.现将13.8克样品加入足量水,样品全部溶解,再加过量的CaCl2溶液,得到9g沉淀,对样品所含杂质的正确判断是( )
A.肯定有Na2CO3
B.肯定有KNO3,可能还含有Na2CO3
C.肯定没有Ba(NO3)2,可能有KNO3
D.肯定没有Na2CO3和Ba(NO3)2难度: 中等查看答案及解析


