-
化学在生活中有着广泛的应用,下列对应关系正确的是( )
A. SO2具有漂白性,可用SO2漂白食物
B. 明矾、二氧化氯可作水杀菌消毒剂
C. 地沟油中的“油”属于油脂,用地沟油可制造肥皂
D. 碳酸钠能与盐酸反应,可用碳酸钠治疗胃酸过多
难度: 简单查看答案及解析
-
NA表示阿伏加德罗常数,下列叙述正确的是( )
A. 在0.1mol/L碳酸钠溶液中阴离子总数大于0.1NA
B. 在铜与硫的反应中,1mol铜失去电子数2NA
C. 31g白磷分子中,含有的共价单键数目是NA
D. 向含0.1mol NH4Al(SO4)2的溶液中滴加NaOH溶液至沉淀恰好完全溶解,消耗的OH- 数为0.5NA
难度: 困难查看答案及解析
-
分子式为C5H10O2并能与饱和NaHCO3溶液反应放出气体的有机物有(不含立体异构)( )
A. 3种 B. 4种 C. 5种 D. 6种
难度: 中等查看答案及解析
-
常温下,下列有关叙述正确的是
A. NaY溶液的pH = 8, c(Na+)–c(Y–)=9.9×10–7mol/L
B. Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
C. pH相等的①NH4NO3 ②(NH4)2SO4 ③NH4HSO4溶液中,c(NH4+)大小顺序①>②>③
D. 10 mL pH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,则所得溶液体积一定为20mL
难度: 困难查看答案及解析
-
下列有关电池的说法不正确的是( )
A.手机上用的锂离子电池属于二次电池
B.锌锰干电池中,锌电极是负极
C.甲醇燃料电池可把化学能转化为电能
D.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
难度: 简单查看答案及解析
-
被誉为“矿石熊猫”的香花石,由我国地质学家首次发现,它由前20号元素中的6种组成,其化学式为Y2X3(ZWR4)3T2,其中X、Y、Z为金属元素,Z的最外层电子数与次外层电子数相等,X、Z位于同族,Y、Z、R、T位于同周期,R最外层电子数是次外层的3倍,T无正价,X与R原子序数之和是W的2倍。下列说法错误的是( )
A. 原子半径:Y>Z>R>T B. 气态氢化物的稳定性:W<R<T
C. 最高价氧化物对应的水化物的碱性:X>Z D. XR2、WR2两种化合物中R的化合价相同
难度: 中等查看答案及解析
-
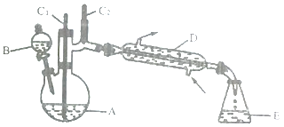
利用右图所示装置进行下列实验,能得出相应实验结论的是( )
选项
①
②
③
实验结论
实验装置
A
稀硫酸
Na2S
AgNO3与AgCl的溶液
Ksp(AgCl)>Ksp(Ag2S)
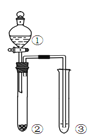
B
浓硫酸
蔗糖
溴水
浓硫酸具有脱水性、氧化性
C
稀盐酸
Na2SO3
Ba(NO3)2 溶液
SO2与可溶性钡盐均可以生成白色沉淀
D
浓硝酸
Na2CO3
Na2SiO3溶液
酸性:硝酸>碳酸>硅酸
A. A B. B C. C D. D
难度: 中等查看答案及解析

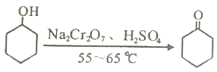
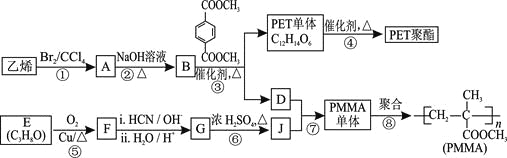
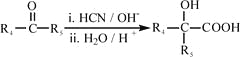 (R4、R5代表烃基)
(R4、R5代表烃基)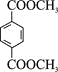 与足量NaOH溶液反应时,最多消耗4 mol NaOH
与足量NaOH溶液反应时,最多消耗4 mol NaOH