-
科技、生产、生活、社会中处处有化学,下列叙述不正确的是
A.汽车尾气、工业排放、建筑扬尘、垃圾焚烧等都是造成雾霾天气的主要原因
B.用于制作航空母舰上拦阻索的钢材是一种合金
C.硅可以制成光电池,能将光能直接转化为化学能
D.加入适量明矾晶体可使浑浊的水变澄清
难度: 中等查看答案及解析
-
从樟科植物枝叶提取的精油中含有一种有机物:
 ,则对该有机物的说法正确的是
,则对该有机物的说法正确的是A.能分别溶于水和CCl4
B.分子中所有原子在同一平面内
C.能使溴水、酸性高锰酸钾溶液褪色
D.能发生硝化反应、酯化反应、水解反应
难度: 中等查看答案及解析
-
设NA代表阿伏加德罗常数的数值,则下列说法正确的是
A.1.8 g D2O含有NA个中子
B.用5 mL 3 mol/L FeCl3溶液制成的氢氧化铁胶体中所含胶粒数为0.015 NA
C.在Na2O2与CO2的反应中,每转移NA个电子时,消耗22.4 L的CO2
D.25℃时,7 g C2H4和C3H6的混合气体中,含有NA个C-H键
难度: 中等查看答案及解析
-
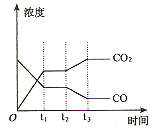
下列图示与对应叙述相符的是

A.图①表示向20 mL 0.1 mol/L氨水中逐滴加入0.1 mol/L醋酸,溶液导电性随加入酸体积的变化
B.图②表示压强对可逆反应A(g)+2B(g)
3C(g)+D(s)的影响,乙的压强比甲的压强大
C.图③中曲线表示反应3A(g) + B(g)
2C(g)△H<0,正、逆反应的平衡常数K随温度的变化
D.据图④,若要除去CuSO4溶液中的Fe3+,可加入NaOH溶液至pH在4左右
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W的原子序数依次增大,其中Y、Z原子的核外电子数之和与X、W原子的核外电子数之和相等,Z单质可以用来冶炼其它熔点较高的金属,X和W间可形成一种能产生酸雨的化合物,则下列说法不正确的是
A.原子半径从大到小顺序为:W>Z>Y>X
B.X与Y可形成既含离子键又含非极性共价键的化合物
C.X、W分别形成简单的氢化物中,前者的沸点高
D.X形成单核阴离子的核外电子数与Y、Z、W原子的核外内层电子数相同
难度: 中等查看答案及解析
-
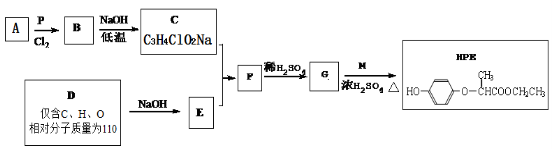
分子式为C5H10N2O3的二肽在酸性条件下可水解为氨基酸(不考虑H2N-COOH和立体异构),这些氨基酸重新组合可形成的二肽共有
A.3种 B.6种 C.9种 D.12种
难度: 中等查看答案及解析
-
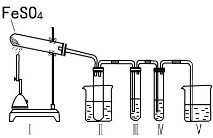
气体的自动化检测中常常应用原电池原理的传感器。下图为电池的工作示意图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号。下表列出了待测气体及敏感电极上部分反应产物。则下列说法中正确的是
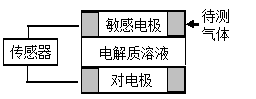
待测气体
部分电极反应产物
NO2
NO
Cl2
HCl
CO
CO2
H2S
H2SO4
A.上述气体检测时,敏感电极均作电池正极
B.检测Cl2气体时,敏感电极的电极反应为:Cl2 + 2e-= 2Cl-
C.检测H2S气体时,对电极充入空气,对电极上的电极反应式为O2 + 2H2O+ 4e- = 4OH-
D.检测H2S和CO体积分数相同的两份空气样本时,传感器上产生的电流大小相同
难度: 中等查看答案及解析