-
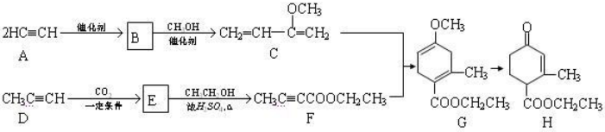
CO2的的资源化利用是解决温室效应的重要途径。以下是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰胺的反应:NH3+CO2→
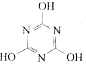 +H2O
+H2O下列有关三聚氰胺的说法正确的是
A.分子式为C3H6N3O3 B.分子中既含极性键,又含非极性键
C.属于共价化合物 D.生成该物质的上述反应为中和反应
难度: 简单查看答案及解析
-
下列有关Fe2(SO4)3溶液的叙述正确的是
A.该溶液中K+、Fe2+、C6H5OH、Br-可以大量共存
B.和KI溶液反应的离子方程式:Fe3++2I-
Fe2++I2
C.和Ba(OH)2溶液反应的离子方程式:Fe3++SO42—+Ba2++3OH-
Fe(OH)3+ BaSO4
D.1 L0.1 mol·L—1该溶液和足量的Zn充分反应,生成11.2 g Fe
难度: 中等查看答案及解析
-
为实现下列实验目的,依据下表提供的主要仪器,所用试剂合理的是
选项
实验目的
主要仪器
试剂
A
分离Br2和CCl4混合物
分液漏斗、烧杯
Br2和CCl4混合物、蒸馏水
B
鉴别葡萄糖和蔗糖
试管、烧杯、酒精灯
葡萄糖溶液、蔗糖溶液、银氨溶液
C
实验室制取H2
试管、带导管的橡皮塞
锌粒、稀HNO3
D
测定NaOH溶液浓度
滴定管、锥形瓶、烧杯
NaOH溶液,0.1000mol/L盐酸
难度: 中等查看答案及解析
-
臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是
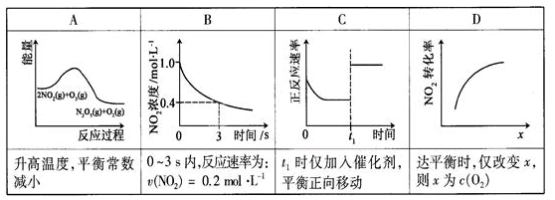
难度: 中等查看答案及解析
-
室温下,下列溶液中粒子浓度大小关系正确的是
A.Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S)
B.Na2C2O4溶液中:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4)
C.Na2CO3溶液:c(Na+)+c(H+)=2c(CO32-)+c(OH-)
D.CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-)
难度: 中等查看答案及解析
-
中学化学中很多“规律”都有适用范围,下列根据有关“规律”推出的结论正确的是
选项
规律
结论
A
较强酸可以制取较弱酸
次氯酸溶液无法制取盐酸
B
反应物浓度越大,反应速率越快
常温下,相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完
C
结构和组成相似的物质,沸点随相对分子质量增大而升高
NH3沸点低于PH3
D
溶解度小的沉淀易向溶解度更小的沉淀转化
ZnS沉淀中滴加CuSO4溶液可以得到CuS沉淀
难度: 中等查看答案及解析
-
室温下,在0.2mol/LAl2(SO4)3溶液中,逐滴加入1.0mol/LNaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如下图,下列有关说法正确的是

A.a点时,溶液呈酸性的原因是Al3+水解,离子方程式为:
Al3++3OH-
Al(OH)3
B.a→b段,溶液pH增大,Al3+浓度不变
C.b→c段,加入的OH-主要用于生成Al(OH)3沉淀
D.d点时,Al(OH)3沉淀开始溶解
难度: 困难查看答案及解析