-
下列各图所反映的措施中,目的是为了加快其化学反应速率的是
A.
 B.
B. 
C.
 D.
D. 
难度: 中等查看答案及解析
-
反应:PCl5(g)
PCl3(g)+Cl2(g)① 2HI(g)
H2(g)+I2(g)② 2NO2(g)
N2O4(g)③在一定条件下,达到化学平衡时,反应物的转化率均是a%。若保持各自的温度不变、体积不变,分别再加入一定量的各自的反应物,则反应物的转化率( )
A. 均不变 B. 均增大
C. ①增大,②不变,③减小 D. ①减小,②不变,③增大
难度: 中等查看答案及解析
-
某温度时,把1 mol N2O4气体通入体积为10 L的真空密闭容器中,立即出现红棕色,反应进行4 s时,NO2的浓度为0.04 mol·L-1,再经过一定时间后,反应达到平衡,这时容器内的压强为开始时的1.8倍。则下列说法正确的是( )
A. 前4 s以N2O4的浓度变化表示的平均反应速率为0.01 mol·L-1·s-1
B. 4 s时容器内的压强为开始时的1.2倍
C. 平衡时容器内含0.4 mol N2O4
D. 平衡时容器内含0.8 mol NO2
难度: 中等查看答案及解析
-
对可逆反应4NH3(g)+5O2(g)
4NO(g)+6H2O(g),下列叙述中正确的是
A. 达到化学平衡时4v正(O2)=5v逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C. 达到化学平衡时,若增大容器的体积,则正反应速率减小,逆反应速率增大
D. 化学反应速率的关系是2v逆(NH3)=3v正(H2O)
难度: 中等查看答案及解析
-
高温下,某反应达到平衡,平衡常数K=
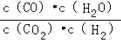 。恒容时,温度升高,H2浓度减小。下列说法正确的是
。恒容时,温度升高,H2浓度减小。下列说法正确的是A. 该反应的焓变为正值
B. 恒温下,增大压强,H2浓度一定减小
C. 升高温度,逆反应速率减小
D. 该反应的化学方程式为CO+H2O
CO2+H2
难度: 中等查看答案及解析
-
反应:L(s)+aG(g)
bR(g)达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡时混合气体中G的体积分数。据此可判断( )
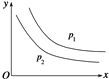
①上述反应是放热反应 ②上述反应是吸热反应 ③a>b ④a<b
A. ①③ B. ①④ C. ②③ D. ②④
难度: 困难查看答案及解析
-
反应CH3OH(l)+ NH3(g)=CH3NH2(g)+ H2O(g)在某温度自发向右进行,若反应的│△H│= 17kJ/mol,│△H-T△S│=17kJ/mol,则下列正确的是( )
A. △H>0,△H- T△S<0 B. △H<0,△H- T△S >0
C. △H>0,△H- T△S >0 D. △H<0,△H- T△S <0
难度: 简单查看答案及解析
-
根据下列有关图象,说法正确的是( )

A. 由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的ΔH<0
B. 由图Ⅱ知,反应在t6时刻,NH3体积分数最大
C. 由图Ⅱ知,t3时采取增大反应体系压强的措施
D. 若图Ⅲ表示在10 L容器、850℃时的反应,由图知,到4 min时,反应放出51.6 kJ的热量
难度: 困难查看答案及解析
-
下列叙述中,不能用平衡移动原理解释的是
A. 红棕色的NO2,加压后颜色先变深后变浅
B. 高压比常压有利于合成NH3的反应
C. 由H2(g)、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深
D. 黄绿色的氯水光照后颜色变浅
难度: 中等查看答案及解析
-
向某密闭容器中充入1 mol CO和2 mol H2O(g),发生反应:CO+H2O(g)
CO2+H2。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是( )
A. 0.5 mol CO+2 mol H2O(g)+1 mol CO2+1 mol H2
B. 1 mol CO+1 mol H2O(g)+1 mol CO2+1 mol H2
C. 0.5 mol CO+1.5 mol H2O(g)+0.4 mol CO2+0.4 mol H2
D. 0.5 mol CO+1.5 mol H2O(g)+0.5 mol CO2+0.5 mol H2
难度: 困难查看答案及解析
-
已知CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH= - Q1 ;2H2(g)+O2(g) =2H2O(g) ΔH= - Q2;H2O(g) =H2O(l) ΔH== - Q3 常温下,取体积比为4:1的甲烷和H2的混合气体112L(标准状况下),经完全燃烧后恢复到常温,则放出的热量为( )
A. 4Q1+0.5Q2 B. 4Q1+0.5Q2+9Q3
C. 4Q1+2Q2 D. 4Q1+Q2+10Q3
难度: 中等查看答案及解析
-
下列事实可以证明HNO2是弱电解质的是( )
①1 mol/L的HNO2溶液可以使石蕊试液变红 ②1 mol/L的HNO2溶液中c(H+)=10-3mol/L ③在相同条件下,HNO2溶液的导电能力比HCl溶液弱 ④10 mL 1 mol·L-1的HNO2溶液恰好与10 mL 1 mol·L-1的NaOH溶液完全反应 ⑤同浓度同体积的HNO2溶液和HCl溶液与Zn反应时,HNO2溶液中放出H2的速率慢 ⑥HNO2溶液中HNO2、NO2-、H+同时存在
A. ③⑤⑥ B. ②③④⑤ C. ①④⑤⑥ D. ②③⑤⑥
难度: 中等查看答案及解析
-
在恒容密闭容器中,可以作为2NO2(g)
2NO(g)+O2(g)达到平衡状态的标志是①单位时间内生成n mol O2的同时生成2n mol NO2;②单位时间内生成n mol O2的同时生成2n mol NO;③混合气体的颜色不再改变;④混合气体的密度不再改变的状态;⑤混合气体的平均相对分子质量不再改变的状态;⑥混合气体中NO与O2的物质的量之比保持恒定;⑦混合气体中NO与NO2的物质的量之比保持恒定( )
A. ①③⑤⑦ B. ②④⑤
C. ①③④ D. ①③⑤⑥⑦
难度: 中等查看答案及解析
-
现有0.1 mol·L-1氨水10 mL,加蒸馏水稀释到1 L后,下列变化中正确的是( )
①电离程度增大 ②c(NH3·H2O)增大 ③NH
数目增多 ④c(OH-)增大 ⑤导电性增强⑥
 增大
增大A. ①②③ B. ①③⑤ C. ①③⑥ D. ②④⑥
难度: 困难查看答案及解析
-
在体积和温度不变的密闭容器中充入a mol X和足量Y,发生反应2X(g)+Y(s)
Z(g)+W(g),建立平衡后,若再加入b mol X,下列判断不正确的是( )
A. 平衡正向移动 B. X的转化率不变
C. Y的转化率增大 D. X的体积分数变大
难度: 中等查看答案及解析
-
取五等份NO2,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:2NO2(g)
N2O4(g) ΔH<0,反应相同时间后,分别测定五个容器中NO2的百分含量(NO2%),并作出NO2%与对应不同温度的五个容器的关系图。下列示意图中,可能与实验结果相符的是( )

A. A B. B C. C D. D
难度: 困难查看答案及解析
-
已知:CO(g)+H2O(g)
CO2(g)+H2(g) ΔH=-41 kJ·mol-1。相同温度下,在容积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
容器编号
起始时各物质物质的量/mol
达平衡过程体系能量的变化
CO
H2O
CO2
H2
①
1
4
0
0
放出热量:32.8 kJ
②
0
0
1
4
热量变化:Q kJ
下列说法中,不正确的是( )
A. 容器①中反应达平衡时,CO的转化率为80%
B. 容器①中CO的转化率等于容器②中CO2的转化率
C. 平衡时,两容器中CO2的浓度相等
D. 容器①时CO的反应速率等于H2O的反应速率
难度: 中等查看答案及解析

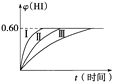
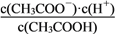

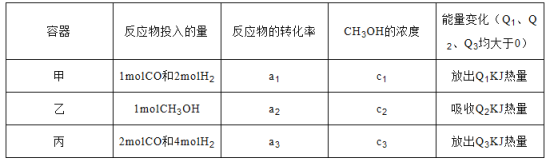
 。请根据图示回答下列问题:
。请根据图示回答下列问题: