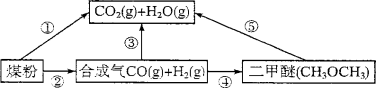
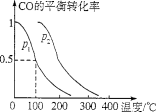
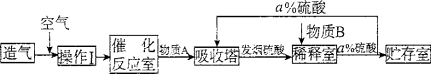
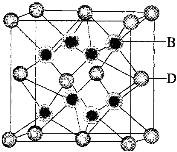
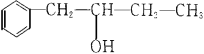
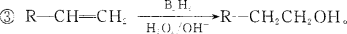-
化学与生产、生活密切相关.下列有关叙述正确的是
A.泡沫灭火器中用的是苏打和硫酸铝
B.通过干馏可将煤中含有的苯、甲苯等物质分离出来
C.地沟油通过水解反应可得到车用汽油
D.家庭用洁厕灵与"84消毒液”不能同时使用
难度: 中等查看答案及解析
-
下列实验操作或叙述正确的是
A.通过导电实验证明氢氧化铁胶体带正电
B.除去苯中溶有的少量乙醇,加入水,振荡,然后分液
C.进行蒸馏操作时.应用温度计准确测量沸腾液体的温度
D.从海带中提取碘时用到的药品有双氧水和NaOH溶液
难度: 中等查看答案及解析
-
分子式为C8H8的某芳香烃,能使酸性高锰酸钾溶液褪色,也能与溴水反应。该芳香烃在一定条件 下与H2完全加成,其生成物的一氯代物的种类有
A.5种 B.6种 C.7种 D.8种
难度: 困难查看答案及解析
-
已知下列物质在20℃下的Ksp如下:
化学式
AgCl
AgBr
AgI
Ag2S
Ag2CrO4
颜色
白色
浅黄色
黄色
黑色
红色
Ksp
2.0×10-10
5.4×10-13
8.3×10-17
2.0×10-41
2.0×10-12
下列说法不正确的是
A.20℃时.AgCl饱和溶液和Ag2CrO4饱和溶液中.Ag+物质的量浓度由大到小的顺序是Ag2CrO4>AgCl
B.20℃时,向相同浓度的KCl和KBr混合溶液中逐滴滴加AgNO3溶液.会先生成浅黄色沉淀
C.20℃时,向相同浓度的KCl和KBr混合溶液中逐滴滴加AgNO3溶液,当两种沉淀共存时.c(Br-):C(C1-)=2.7×10-3
D.在100ml AgCl、 AgBr 、AgI饱和的混合溶液中加入足量浓AgNO3溶液,产生沉淀AgI质量最多
难度: 困难查看答案及解析
-
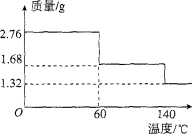
有关下列图像的分析错误的是
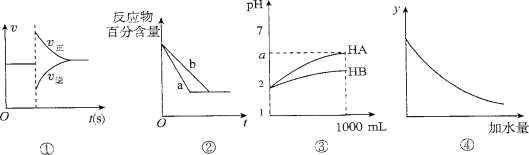
A.图①可表示对平衡N2+3H2
2NH3加压、同时移除部分NH3时的速率变化。
B.图②中a、b曲线只可表示反应H2(g)十I2(g)
2HI(g)在有催化剂和无催化剂存在下建立平衡的 过程。
C.图③表示室温下将各1 ml pH=2的HA、HB两种酸溶液加水稀释的情况。若2<a<5,则两酸都为弱酸
D.图④中的y可表示将O.1 mol/l稀醋酸加水稀释时溶液导电能力的变化情况
难度: 困难查看答案及解析
-
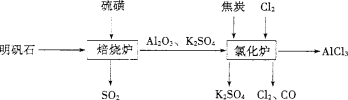
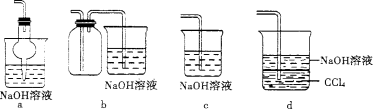
对下列装置作用的分析或解释正确的是

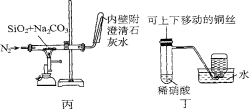
A.装置甲可除去HCl中的Cl2杂质
B.装置乙可吸收SO2,并防止倒吸
C.装置丙石灰水变浑浊即可证明非金属性:Si>C
D.装置丁可制取并收集NO气体
难度: 中等查看答案及解析
-
某温度下,体积和pH都相同的稀硫酸和硫酸铝溶液加水稀释时的pH变化曲线如图,
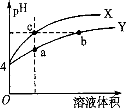
下列有关说法正确的是
A.加等量的水后硫酸中水电离出的C(H+)与硫酸铝中水电离出的C(H+)的比值比稀释前的比值增大
B.a点溶液中有:c(H+)+c(Al3+)=c(OH-)+c(SO42一)
C.体积和pH都相同的稀硫酸和硫酸铝溶液与等浓度的NaOH反应,消耗NaOH的体积相等
D.b、c两溶液水电离出的c(OH-)相等。
难度: 困难查看答案及解析