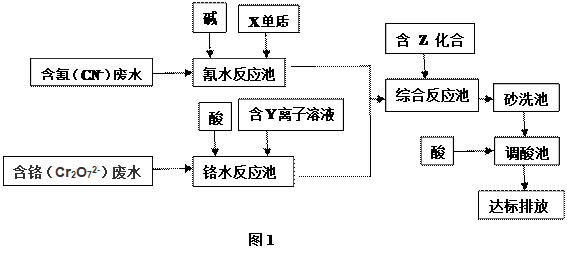
-
化学与科学、技术、社会、环境密切相关。下列有关说法中正确的是 ( )
A. 为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰
B. 节日燃放的焰火是某些金属元素焰色反应所呈现出来的色彩
C. 化学药品着火,都要立即用水或泡沫灭火器灭火
D. 自来水净化过程中加入明矾的作用是消毒杀菌
难度: 中等查看答案及解析
-
用下列装置进行实验能达到相应实验目的的是
A. 用该装置收集NO

B. 分离氢氧化铁胶体和氯化钠溶液
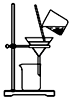
C. 实验室中制取少量蒸馏水
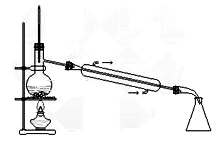
D. 配制100 mL 0.10 mol﹒L-1盐酸
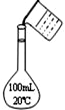
难度: 中等查看答案及解析
-
下列有关物质的分类或归类中正确的是( )
A. 化合物:HT、CaCl2、NaOH、盐酸
B. 纯净物:水玻璃、胆矾晶体、液氯、硫酸
C. 天然高分子化合物:淀粉、纤维素、蛋白质、聚氯乙烯
D. 同分异构体:CH3CH2CH2CH2CH3、CH3CH2CH(CH3)2、C(CH3)4
难度: 中等查看答案及解析
-
下列有关化学用语使用正确的是( )
A. 原子核内有10个中子的氧原子:
O B. NaCl的电子式为
C. 硫原子的原子结构示意图:
D. HClO的结构式为H—Cl—O
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数,下列说法正确的是( )
A. 常温常压下,等质量的N2和CO气体的原子数均为2NA
B. 含有3mol离子的过氧化钠固体和足量的水反应,电子转移数为NA
C. 22.4 L CH4与18g H2O所含有的质子数均为10NA
D. 将0.1mol氯化铁溶于1L水中,所得溶液中有0.1NA个Fe3+
难度: 中等查看答案及解析
-
下列说法不正确的是
A.温度相同、体积相同的O2(g)和N2(g)分子数相同
B.等温等压下,SO2气体与CO2气体的密度之比等于16∶11
C.温度、容积相同的两气罐中各盛有5mol O2和2 mol N2,容器压强之比等于5∶2
D.等温等压条件下, 5 molO2(g)和2 molH2 (g)的体积之比等于5∶2
难度: 中等查看答案及解析
-
下列各组中两种物质在溶液中的反应,可用同一离子方程式表示的是( )
A. Cu(OH)2+HCl;Cu(OH)2+CH3COOH
B. CaCO3+H2SO4;Na2CO3+HCl
C. H2SO4+NaOH;H2SO4+Ba(OH)2
D. BaCl2+H2SO4;Ba(OH)2+Na2SO4
难度: 中等查看答案及解析
-
下列各项操作中不发生先沉淀后溶解现象的是( )
①向饱和碳酸钠溶液中通入过量的CO2 ②向Fe(OH)3胶体中逐滴滴加过量的H2SO4
③Ba(NO3)2溶液中通入过量SO2 ④向NaAlO2溶液中逐滴加入过量的稀盐酸
⑤向硅酸钠溶液中逐滴加入过量的盐酸
A. ①②③ B. ①②⑤ C. ①②③⑤ D. ①③⑤
难度: 中等查看答案及解析
-
在水溶液中能大量共存的一组离子是( )
A. Al3+、Na+、HCO3-、SO42- B. K+、Na+、SO42-、MnO4-
C. H+、Fe2+、ClO-、Cl- D. K+、CO32-、NO3-、H+
难度: 中等查看答案及解析
-
用右图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
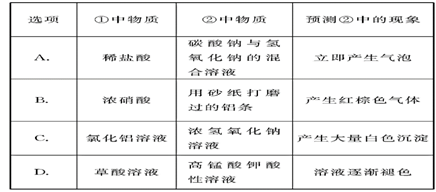
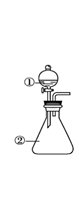
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
下列实验的反应原理用离子方程式表示正确的是( )
A. 用小苏打治疗胃酸过多:CO32- + 2H+= CO2↑ + H2O
B. 石灰水中加入过量碳酸氢钠溶液:HCO3- + Ca2+ + OH- = CaCO3↓ + H2O
C. 用氢氧化钠溶液除去镁粉中的杂质铝:2Al + 2OH- + 2H2O = 2AlO2- + 3H2↑
D. 室温下,测得氯化铵溶液PH<7: NH4+ + H2O = NH3﹒H2O + H+
难度: 中等查看答案及解析
-
下列有关氧化还原反应的叙述正确的是( )
A. 肯定有一种元素被氧化,另一种元素被还原
B. 在反应中不一定所有元素的化合价都发生变化
C. 置换反应不一定属于氧化还原反应
D. 化合反应和复分解反应中不可能有氧化还原反应
难度: 中等查看答案及解析
-
将0.195 g锌粉加入到20.0 mL的0.100 mol·L-1 MO
溶液中,恰好完全反应,则还原产物可能是( )
A. M B. M2+
C. M3+ D. MO2+
难度: 中等查看答案及解析
-
只用胶头滴管和试管,不用其他试剂就可以区别的下列溶液是 ( )
A. CaCl2和Na2CO3 B. 稀HCl和Na2CO3溶液
C. Ba(OH)2和NaHCO3 D. NaAlO2和NaOH溶液
难度: 中等查看答案及解析
-
下列选项的括号内是除去杂质所用的试剂,错误的是( )
A. Cl2中混有HCl(饱和食盐水)
B. SiO2中混有CaCO3(盐酸)
C. CO2中混有SO2(饱和NaHCO3溶液)
D. FeSO4溶液中混有CuSO4(Zn粉)
难度: 中等查看答案及解析
-
下列物质均为a g,将它们在氧气中完全燃烧的产物全部通入到足量的过氧化钠固体中,则过氧化钠固体增重为a g的是( )
①CO ②H2 ③CH4 ④HCHO ⑤CH3COOH ⑥HCOOH
A. ①②⑥ B. ③④⑤ C. ①②④⑤ D. ②③⑤
难度: 困难查看答案及解析