-
下列关于硫及其化合物的说法正确的是
A. 自然界中不存在游离态的硫
B. 二氧化硫的排放会导致光化学烟雾和酸雨的产生
C. 二氧化硫能使滴有酚酞的氢氧化钠溶液褪色,体现了二氧化硫的漂白性
D. 浓硫酸可用来干燥SO2、CO、Cl2等气体
难度: 简单查看答案及解析
-
室温下,下列各组离子能大量共存的是
A. 稀硫酸中:K+、Mg2+、A1O2-、S2O32-
B. NaHS 溶液中:SO42-、K+、C1-、Cu2+
C. KW/c(H+)=10-13 mol·L-1 的溶液中:Fe3+、NH4+、Mg2+、SO42-
D. 通人大量 CO2 的溶液中:Na+、ClO-、CH3COO-、HCO3-
难度: 中等查看答案及解析
-
下列说法中不正确的是
A. 硅主要以单质、氧化物、硅酸盐的形式存在于自然界中
B. 适量CO2通入漂白粉的水溶液可以生成白色沉淀
C. 在燃煤中加入石灰石可减少SO2的排放,发生的总反应为2CaCO3+2SO2+O2
2CO2+2CaSO4
D. 不能用玻璃瓶来盛装氟化钠水溶液
难度: 中等查看答案及解析
-
合金是指两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质。分析下表数据,不能形成合金的是
Na
Cu
A1
Fe
熔点/℃
97.8
1 083
660
1 535
沸点/℃
883
2 567
2 467
2 750
A. Cu和A1 B. Fe和Na C. Fe和Cu D. A1和Na
难度: 简单查看答案及解析
-
下列反应中,反应后固体物质的质量不变的是
A. 氢气通过灼热的CuO粉末 B. 二氧化碳通过Na2O2粉末
C. 铝与Fe2O3发生铝热反应 D. 将铁钉投入Cu(NO3)2溶液
难度: 简单查看答案及解析
-
下列解释物质用途或现象的反应方程式不准确的是
A. 硫酸型酸雨的形成会涉及反应2H2SO3+O2
2H2SO4
B. 工业上制取粗硅的化学方程式:SiO2+C
Si+CO2↑
C. Na2S2O3溶液中加入稀硫酸:S2O32-+2H+=SO2+S↓+H2O
D. 成分为盐酸的洁厕灵与84消毒液混合使用易中毒:Cl-+ClO-+2H+=Cl2↑+H2O
难度: 中等查看答案及解析
-
下列离子方程式的书写正确的是
A.水玻璃中通人过量二氧化碳:Na2SiO3+CO2+H2O =2Na++CO32-+H2SiO3↓
B.Na202加入H2180中:2Na2O2+2H218O=4Na++4OH-+18O2↑
C.硅与氢氟酸的反应:Si+4H++4F-=SiF4↑+2H2↑
D.过量C02通入氢氧化钙溶液中:CO2+OH-=HCO3-
难度: 中等查看答案及解析
-
海水是巨大的资源宝库,下列说法正确的是
A. 碘元素又称“海洋元素”
B. 从海水中提取食盐和碘的过程都是物理变化
C. 镁是海水中含量最多的金属元素
D. 氯碱工业和纯碱工业的原料都有食盐
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列叙述正确的是
A. 常温常压下,92 g的NO2和N2O4混合气体中含有的原子数为6NA
B. 惰性电极电解食盐水,若电路中通过NA个电子,则阳极产生气体11.2 L
C. 0. 25 mol Na2O2中含有的阴离子数为0.5NA
D. 在反应KIO3+6HI==KI+3I2+3H2O中,每生成3 molI2转移的电子数为6NA
难度: 困难查看答案及解析
-
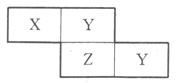
下表各组物质中,物质之间不可能实现如下图所示转化的是
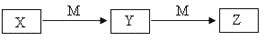
选项
X
Y
Z
M
A
Fe
FeCl2
FeCl3
Cl2
B
Mg
C
CO
CO2
C
NaOH
Na2CO3
NaHCO3
CO2
D
NH3
NO
NO2
O2
难度: 中等查看答案及解析
-
X、Y、Z是中学化学常见的三种有色物质(其组成元素均属于短周期元素),摩尔质量依次增大,它们均能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂。下列说法正确的是
A. X、Y、Z中,只有Y能使湿润的淀粉-碘化钾试纸变蓝
B. 1 mol Y或Z与足量水完全反应时,均转移2 mol电子
C. Z为离子化合物,但含有非极性键,阴、阳离子个数比为1 : 2
D. X和Y均能用向上排空气法和排水法收集
难度: 中等查看答案及解析
-
某澄清、透明的浅黄色溶液中可能含有H+、NH4+、Fe3+、Ba2+、Al3+、SO42-、HCO3-、I-八种离子中的几种,在检验方案设计时初步分析其溶液中最多可含的离子(不包括OH-)有
A. 5 种 B. 6 种 C. 7 种 D. 8 种
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A. 氯化钙溶液中通入CO2气体:Ca2++ CO2 + H2O==CaCO3↓+2H+
B. 以石墨作电极电解氯化铝溶液:2C1-+2H2O
2OH-+H2↑+C12↑
C. Ca(C1O)2 溶液中通入过量的SO2 气体:ClO-+SO2 + H2O==HC1O+HSO3-
D. 向明矾溶液中加人氢氧化钡溶液至沉淀的质量最大:Al3++2SO42-+2Ba2+ +4OH-==2BaSO4↓+AlO2-+2H2O
难度: 困难查看答案及解析
-
下列有关物质的应用与性质相对应的说法正确的有
①明矾能用于净水是因为铝离子水解生成的氢氧化铝胶体具有强氧化性
②氯化铁溶液可用于制作印刷电路板是因为其能氧化单质铜
③浓硫酸可用作干燥剂是因为其具有脱水性
④光导纤维可用作通讯材料是因为其具有导电性
⑤MgO、Al2O3的熔点很高,可制作耐高温材料
⑥NaHCO3能与碱反应,因此食品工业上可用作焙制糕点的膨松剂
⑦A1具有良好的延展性和抗腐蚀性,可制成铝箔包装物品
A. 2个 B. 3个 C. 4个 D. 5个
难度: 中等查看答案及解析
-
下列离子方程式书写不正确的是
A. A1C13 溶液与烧碱溶液反应,当n(OH-) :n(A13+)=7 : 2 时,2A13++7OH-==A1(OH)3↓+ AlO2-+2H2O
B. 当向饱和Na2CO3溶液中通入过量CO2时,CO32-+CO2 + H2O==2HCO3-
C. CuCl2 溶液与 NaHS 溶液反应,当n(CuCl2):n(NaHS) = l : 2 时,Cu2++2HS-==CuS↓十H2S↑
D. Fe 与稀硝酸反应,当 n(Fe) : n(HNO3)=l : 2 时,3Fe+2NO3-+8H+==3Fe2+ +2NO↑+4H2O
难度: 困难查看答案及解析
-
向含1mol HCl和1mol MgSO4的混合溶液中加入1 mo1·L-1Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系如图三其中正确的是
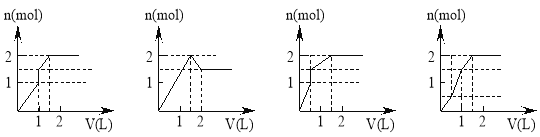
A. B. C. D.
难度: 困难查看答案及解析
-
已知:将Cl2通入适量NaOH溶液中,产物中可能含有NaCl、NaClO、NaC1O3,且c(Cl-)/c(ClO-)的值与温度高低有关。当n(NaOH)=a mol时,下列说法不正确的是
A. 参加反应的氯气的物质的量等于1/2a mol
B. 改变温度,产物中NaC1O3的最大理论产量为1/7a mol
C. 改变温度,反应中转移电子的物质的量n(e_)的范围为1/2amol≤n(e_)≤5/6amol
D. 若某温度下,反应后c(Cl-)/c(ClO-)= 11,则溶液中c(ClO-)/c(ClO3-)= 1/2
难度: 困难查看答案及解析
-
根据下面的海水综合利用的工业流程图,判断下列说法正确的是
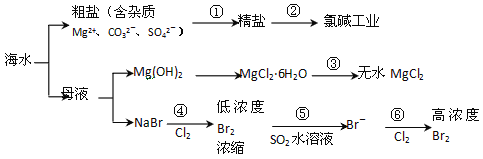
已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。
A. 过程①的提纯是物理过程,过程②通过氧化还原反应可产生2种单质
B. 在过程③中将MgCl2·6H2O灼烧即可制得无水MgCl2
C. 在过程④、⑥反应中每氧化0.2 mol Br- 需消耗2. 24 L Cl2
D. 过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题
难度: 中等查看答案及解析
-
C和CuO在一定温度下反应,产物有Cu、Cu2O、CO 、CO2。若将2.00gC与16.0gCuO混合,隔绝空气加热,将生成的气体全部通入足量的澄清石灰水,反应一段时间后共收集到1.12 L (标准状况)气体,生成沉淀的质量为5.00 g。下列说法不正确的是
A. 反应后的固体混合物中Cu的质量为12. 8 g
B. 反应后的固体混合物中含有碳
C. 反应后的固体混合物总质量为14. 4 g
D. 反应后的固体混合物中氧化物的物质的量为0.05 mol
难度: 困难查看答案及解析
-
在一定温度下,某浓度的硝酸与金属锌反应生成NO2和NO,两者的物质的量之比为1 : 3,则要使1 mol金属锌完全反应,反应过程中消耗此硝酸的物质的量为
A. 2.4 mol B. 2.6 mol C. 2.8mol D. 3.2 mol
难度: 中等查看答案及解析
-
“三效催化转换器”可将汽车尾气中的有毒气体处理为无污染的气体,下图为该反应的微观示意图(未配平),其中不同符号的球代表不同种原子。下列说法不正确的是
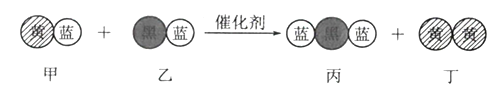
A. 甲和丙中同种元素的化合价不可能相等 B. 该反应属于氧化还原反应
C. 丁物质一定是非金属单质 D. 配平后甲、乙、丙的化学计量数均为2
难度: 简单查看答案及解析
-
短周期主族元素.X、Y、Z、W、Q的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物中,常温下,Z的单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液。下列说法不正确的是
A. 原子半径的大小顺序为W>Q>Z>X>Y
B. 元素X的气态氢化物与Q的单质可发生置换反应
C. 元素X与Y可以形成5种以上的化合物
D. 元素Q的最高价氧化物对应水化物的酸性比W的强
难度: 简单查看答案及解析
-
1.76 g铜镁合金完全溶解于50 mL、密度为1. 40 g • cm-3、质量分数为63%的浓硝酸中,得到NO2气体1 792 mL(标准状况),向反应后的溶液中加入适量的1.0 mol • L-1的NaOH 溶液,恰使溶液中的金属离子全部沉淀。下列说法不正确的是
A. 该浓硝酸中的HNO3的物质的量浓度是14.0 mol • L-1
B. 加入NaOH溶液的体积是50 mL
C. 浓硝酸在与合金的反应中起了酸性和氧化性的双重作用,且起氧化性的硝酸的物质的量为0.08 mol
D. 得到的金属氢氧化物的沉淀为3.12 g
难度: 中等查看答案及解析
-
下图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量。下列反应对应的曲线不正确的是
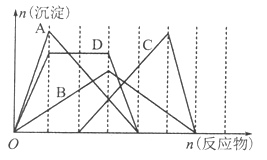
A. 向NaA1O2溶液中滴人HC1至过量
B. 向澄清石灰水中通人CO2至过量
C. 向含有盐酸的A1C13溶液中滴人NaOH溶液至过量
D. 向含有等物质的量的Ca(OH)2、KOH的混合溶液中通入CO2至沉淀消失
难度: 简单查看答案及解析
-
根据表中信息判断,下列选项正确的是
序号
反应物
产物
①
KMnO4,H2O2,H2SO4
K2SO4、MnSO4………
②
Cl2、FeBr2
FeCl3、FeBr3
③
MnO4-…………
Cl2、Mn2+
A. 第①组反应的其余产物为H2O
B. 第②组反应中Cl2与FeBr2的物质的量之比小于或等于1 : 2
C. 第③组反应中生成1 mol Cl2,转移电子5 mol
D. 氧化性由强到弱的顺序为MnO4->Cl2>Fe3+>Br2
难度: 中等查看答案及解析
-
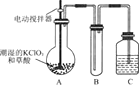
如图所示的实验,发现烧杯中酸性KMnO4溶液褪色。若将烧杯中的溶液换成含有少量KSCN的FeSO4溶液,溶液呈血红色。判断下列说法中不正确的是( )
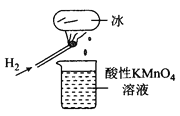
A. 该条件下H2燃烧生成了既具有氧化性又具有还原性的物质
B. 该条件下H2燃烧的产物中可能含有一定量的H2O2
C. 将烧杯中溶液换成KI淀粉溶液也能验证生成物具有还原性
D. 酸性FeSO4溶液中加入双氧水的离子反应为:2Fe2++H2O2+2H+=2Fe3++2H2O
难度: 中等查看答案及解析
-
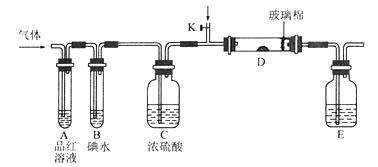
下列药品和装置合理且能完成相应实验的是
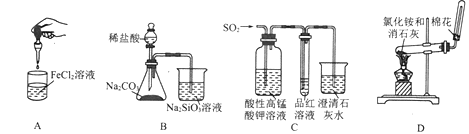
A. 制备氢氧化亚铁 B. 验证非金属性Cl>C>Si
C. 检验二氧化硫中是否混有二氧化碳 D. 实验室制取并收集氨
难度: 简单查看答案及解析
-
2.8 g Fe全部溶于一定浓度、200 mL的HNO3溶液中,得到标准状况下的气体1.12 L,测得反应后溶液的pH为1。若反应前后溶液体积变化忽略不计,则下列有关判断正确的是
A. 反应后的溶液最多还能溶解1. 4 g Fe
B. 反应后溶液中 c(NO3-)=0.85 mol • L-1
C. 反应后溶液中铁元素可能以Fe2+形式存在
D. 1.12 L气体可能是NO、NO2的混合气体
难度: 困难查看答案及解析
-
某溶液中含有的离子可能是K+、Ba2+、A13+、Mg2+、A1O2-、CO32-、SiO32-、C1-中的几种,现进行如下实验:
①取少量溶液加氢氧化钠溶液过程中无沉淀生成;
②另取少量原溶液,逐滴加入5 mL 0.2 mol • L-1的盐酸,发生的现象是开始产生沉淀并逐渐增多,沉淀量基本不变后产生气体,最后沉淀逐渐减少至消失;
③在上述②沉淀消失后的溶液中,再加入足量的硝酸银溶液可得到沉淀0.435 g。
下列说法中正确的是
A. 该溶液中一定不含有Ba2+、Mg2+、A13+、SiO32-、C1-
B. 该溶液中一定含有K+、A1O2-、CO32-、C1-
C. 该溶液中是否含有K+需做焰色反应(透过蓝色钴玻璃片)
D. 可能含有C1-
难度: 困难查看答案及解析