-
下列过程中△H<0的是( )
A. 氯化铵和氢氧化钡晶体混合 B. 冰→水→水蒸气
C. 煅烧石灰石制生石灰 D. 盐酸与NaOH溶液反应
难度: 简单查看答案及解析
-
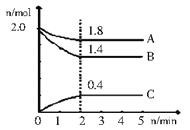
某反应由两步反应A
B
C构成,反应过程中的能量变化曲线如图(E1、E3表示两反应的活化能)。下列有关叙述正确的是( )

A. 三种化合物的稳定性顺序:B﹤A﹤C
B. 两步反应均为放热反应
C. 整个反应的ΔH=E1-E2
D. 加入催化剂不改变反应的焓变,但能提高产率
难度: 困难查看答案及解析
-
下列说法或表示正确的是:( )
A. 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B. 放热反应不需加热即可发生
C. 稀溶液中:H++OH-=H2O, ΔH=-57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合放出的热量大于57.3kJ
D. 在25℃、101kPa时,2g H2完全燃烧生成液态水,放出285.5kJ的热量,则表示H2燃烧热的热化学方程式为:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ/mol
难度: 中等查看答案及解析
-
已知热化学方程式2SO2(g)+ O2(g) ⇌ 2 SO3(g) △H= -Q kJ/mol(Q>0),则下列说法正确的是( )
A. 2molSO2(g)和1mol O2(g)所具有的总能量小于2 molSO3(g)所具有的能量
B. 将2molSO2(g)和1mol O2(g)置于一密闭容器中充分反应后放出QkJ的热量
C. 升高温度,平衡向逆反应方向移动,上述热化学方程式中的Q值减小
D. 如将一定量SO2(g)和 O2(g)置于某密闭容器中充分反应后放热QkJ,则此过程中有2molSO2(g)被氧化
难度: 中等查看答案及解析
-
关于强、弱电解质的叙述不正确的是( )
A. 强电解质在溶液中完全电离,其水溶液中不存在分子
B. 同一弱电解质溶液,温度不同时,导电能力不同
C. 强电解质溶液导电能力不一定比弱电解质溶液的导电能力强
D. 强电解质在液态时不一定会导电,但在固态时一定不导电
难度: 简单查看答案及解析
-
已知反应4CO+2NO2
N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )
A. υ(CO)=1.5 mol·L-1·min-1 B. υ(NO2)=0.7 mol·L-1·min-1
C. υ(N2)=0.4 mol·L-1·min-1 D. υ(CO2)=1.1 mol·L-1·min-1
难度: 中等查看答案及解析
-
在密闭容器中,一定条件下进行如下反应:NO(g)+CO(g)
N2(g)+CO2(g)△H=-373.2KJ/mol,达到平衡后,为提高NO的转化率和该反应的速率,可采取的措施是
A. 加催化剂同时升高温度
B. 加催化剂同时增大压强
C. 升高温度同时充入N2
D. 降低温度同时增大压强
难度: 中等查看答案及解析
-
一定温度下,可逆反应2NO2(g)
2NO(g)+O2(g)在体积固定的密闭容器中反应,达到平衡状态的标志是
①单位时间内生成n mol O2,同时生成2n mol NO2
②单位时间内生成n mol O2,同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1
④混合气体的压强不再改变
⑤混合气体的颜色不再改变
⑥混合气体的平均相对分子质量不再改变
A. ①④⑤⑥ B. ①②③⑤ C. ②③④⑥ D. 以上全部
难度: 中等查看答案及解析
-
容积固定的密闭容器中,达平衡的可逆反应2A(g)
2B(?) + C (?)(△H>0),若随着温度升高,气体平均相对分子质量减小,则下列判断正确的是:( )
A. B和C可能都是液体 B. B和C肯定都是气体
C. B和C可能都是固体 D. 若C为固体,则B一定是气体。
难度: 困难查看答案及解析
-
用铁片与50 mL 1 mol/L的硫酸反应制取H2时,下列措施不能使氢气生成速率加大是:( )
A. 对该反应体系加热 B. 滴加几滴浓硫酸
C. 加入少量CH3COONa固体 D. 不用铁片,改用铁粉
难度: 简单查看答案及解析
-
反应C(s)+H2O(g)
CO(g)+H2(g) △H>0在一定密闭容器中进行,则下列说法或结论中,能够成立的是( )
A. 其他条件不变,仅将容器的体积缩小一半,反应速率减小
B. 其他条件不变,升高温度,反应速率加快且H2O(g)转化率增大
C. 保持体积不变,充入少量He使体系压强增大,反应速率一定增大
D. 其他条件不变,适当增加C(s)的质量会使反应速率增大
难度: 中等查看答案及解析
-
右图是温度和压强对X+Y
2Z反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )
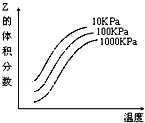
A. 上述可逆反应的正反应为放热反应 B. X、Y、Z均为气态
C. X和Y中只有一种是气态,Z为气态 D. 上述反应的逆反应的△H>0
难度: 中等查看答案及解析
-
根据所学知识判断,下列反应中,在任何温度下都不自发进行的是( )
A. 2O3(g)═3O2(g)△H<0 B. N2(g)+3H2(g)═2NH3(g)△H<0
C. 2CO(g)═2C(s)+O2(g)△H>0 D. CaCO3(s)═CaO(s)+CO2(g)△H>0
难度: 简单查看答案及解析
-
在100mL下列溶液中,分别加入0.05molNaOH固体,溶液的导电性变化不大的是( )
A. 0.5mol/L的HCl B. 0.5mol/L的CH3COOH
C. 蒸馏水 D. 0.5mol/L的氨水
难度: 中等查看答案及解析
-
有等体积、等pH的Ba(OH)2、KOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是( )
A. V3>V2>V1 B. V3=V2=V1 C. V3>V2=V1 D. V1=V2>V3
难度: 中等查看答案及解析
-
一定温度下,有可逆反应:2A(g)+2B(g)
C(g)+3D(g);ΔH<0。现将2 mol A和2 mol B充入体积为V的甲容器,将2 mol C和6 mol D充入乙容器并使乙容器在反应开始前的体积为2V(如图1)。
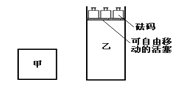
关于两容器中反应的说法正确的是( )
A.两容器达平衡后升高相同的温度时,甲容器的反应速率大于乙容器的速率
B.两容器中的反应均达平衡时,平衡混合物中各组份的体积百分组成相同,混合气体的密度不同
C.甲容器中的反应先达到化学平衡状态
D.在甲容器中再充入2mol A和2 mol B,平衡后甲中物质C的物质的量是乙中物质C的物质的量的2倍
难度: 困难查看答案及解析