-
美国现任总统奥巴马就环境问题公开表示,到2020年,美国将会把温室气体排放量削减到1990年水平的80%,此外美国将把新能源比重提高到30%。下列说法不正确的是
A.CO2属于温室气体
B.太阳能电池可将太阳能直接转化为电能
C.太阳能属于新能源
D.乙醇属不可再生能源,乙醇燃烧不会产生温室气体
难度: 中等查看答案及解析
-
我国第五套人民币中的一元硬币材料为钢芯镀镍,依据你所掌握的电镀原理,你认为在硬币制作时,钢芯应做
A.正极 B.负极 C.阴极 D.阳极
难度: 中等查看答案及解析
-
可逆反应2HI(g)
I2(g)+H2(g)在密闭容器中进行,当下列中的四项中的某项不随时间变化时,不能说明反应达到平衡的是
A.各组分的物质的量 B.混合物的温度
C.容器内压强 D.混合气体的颜色
难度: 中等查看答案及解析
-
下列过程需要通电才能进行的是
①电离 ②电镀 ③电解 ④电化学腐蚀 ⑤铜的精练
A.①③④ B.②③⑤ C.①②③ D.全部
难度: 中等查看答案及解析
-
下列各图表示的装置,能构成原电池的是

难度: 中等查看答案及解析
-
对于反应A + B = C,下列条件的改变一定使化学反应速率加快的是
A.升高体系的温度 B.增加体系的压强
C.减少C的物质的量浓度 D.增加A的物质的量
难度: 中等查看答案及解析
-
已知化学反应A2(g)+B2(g)===2AB(g) ΔH= Q kJ·mol-1,其能量变化如下图所示,

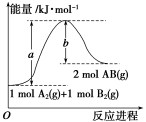 则Q的值正确的是
则Q的值正确的是A.a-b B.a C.-b D.b-a
难度: 中等查看答案及解析
-
下列说法,你认为不正确的是
A.平衡常数随温度的改变而改变
B.对于密闭容器中反应2SO2+O2
2SO3,2体积SO2与足量O2反应,能生成2体积SO3
C.合成氨反应中使用催化剂,降低了反应所需要的活化能。
D.反应H2(g)+I2 (g)
2HI(g) 在450℃时,其平衡常数为49;则反应HI(g)
1 ∕ 2 H2(g) +1 ∕ 2 I2(g) 在450℃时的平衡常数为1 ∕ 7
难度: 中等查看答案及解析
-
下图为直流电源电解稀Na2SO4溶液的装置。通电一段时间后,在石墨电极a和b附近分别滴加一滴酚酞溶液。则下列有关说法中正确的是
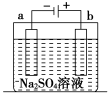
A.a电极产生H2
B.两极产生的气体均有刺激性气味
C.通电一段时间后,稀Na2SO4溶液酸性增强
D.a电极附近呈无色,b电极附近呈红色
难度: 中等查看答案及解析
-
一定条件下,某反应的化学方程式为:CO2+NO
NO2+CO ,下列说法正确的是
A.升高温度,正反应速率增大,逆反应速率减少
B.恒温时,压缩容器的体积,颜色加深,因平衡左移
C.达到平衡,其平衡常数为
D.恒容时,升高温度,混合气体的颜色加深,该反应的焓变为正值
难度: 中等查看答案及解析
-
下列热化学方程式正确的是(ΔH的绝对值均正确)
A.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g) ΔH=+1367.0 kJ· mol-1(燃烧热)
B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=+57.3 kJ· mol-1(中和热)
C.S +O2 = = SO2 ΔH=+269.8 kJ· mol-1(反应热)
D.2H2(g)+ O2(g)===2H2O(l) ΔH=-571.6 kJ· mol-1(反应热)
难度: 中等查看答案及解析
-
下列关于实验现象的描述不正确的是
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.用锌片做阳极,铁片做阴极,电解氯化铜溶液,铁片表面析出铜
C.把铜片插入三氯化铁溶液,在铜片表面析出铁
D.把锌放入稀盐酸中,加几滴氯化铜溶液,产生气泡速率加快
难度: 中等查看答案及解析
-
利用生活中常见的材料可以进行很多科学实验,甚至制作出一些有实际应用价值的装置来,
如废铝罐和碳棒,食盐水等材料制作可用于驱动玩具的电池。上述电池工作时,有关说法正确的是
A.铝罐将逐渐被腐蚀
B.碳棒上发生的反应为:O2+4e-===2O2-
C.碳棒应与玩具电机的负极相连
D.该电池工作一段时间后碳棒的质量会减轻
难度: 中等查看答案及解析
-
在一容积可变的密闭容器中,aA(气)
bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
A.平衡向正反应方向移动了 B.物质A的转化率减少了
C.物质B的质量分数减小了 D.化学计量数关系a>b
难度: 中等查看答案及解析
-
钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为:2Fe+2H2O+O2 = 2Fe2++4OH-。以下说法正确的是
A.负极发生的反应为:Fe-2e- = Fe2+
B.正极发生的反应为:2H2O+O2+2e- = 4OH-
C.原电池是将电能转变为化学能的装置
D.钢柱在水下部分比在空气与水交界处更容易腐蚀
难度: 中等查看答案及解析
-
将等质量的a、b两份锌粉装入试管中,分别加入过量的稀硫酸,同时向装a的试管中加入少量CuSO4溶液。下图表示产生氢气的体积V与时间t的关系,其中正确的是
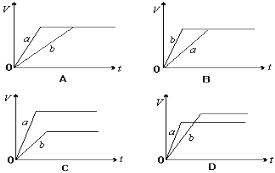
难度: 中等查看答案及解析
-
往一体积不变的密闭容器中充入H2和I2,发生反应H2 (g) + I2 (g)
2HI(g) △H<0,
当达到平衡后,t0时刻改变某一条件(混合气体量不变),容器内压强增大,下列说法正确的是
A.可能为升温 B.平衡一定不移动
C.H2 转化率增大 D.HI平衡浓度一定变大
难度: 中等查看答案及解析
-
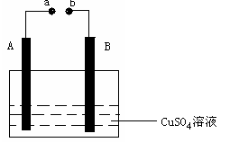
某同学组装了如图所示的电化学装置,电极Ⅰ为Zn,其他电极均为Cu,
则下列说法正确的是
 A.电子移动:电极Ⅰ→电极Ⅳ→电极Ⅲ→电极Ⅱ
A.电子移动:电极Ⅰ→电极Ⅳ→电极Ⅲ→电极Ⅱ B.电极Ⅰ发生还原反应
C.电极Ⅳ逐渐溶解
D.电极Ⅲ的电极反应:Cu-2e-===Cu2+
难度: 中等查看答案及解析

 ①烧杯间填满碎泡沫塑料的作用是
①烧杯间填满碎泡沫塑料的作用是