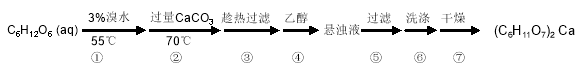
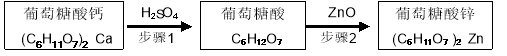
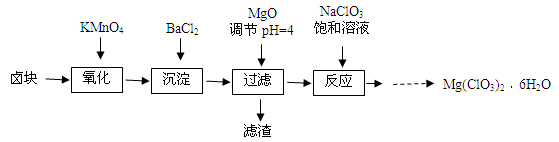
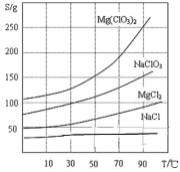
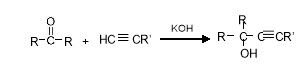
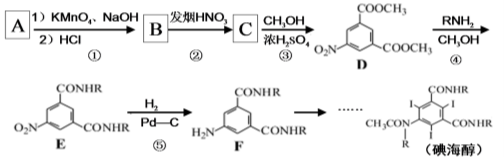
-
生活处处有化学,下列说法正确的是
A.氢氧化铝可作胃酸过多的中和剂
B.福尔马林可作食品的保鲜剂
C.用聚乙烯塑料代替聚乳酸塑料可减少白色污染
D.煎炸食物的花生油、牛油都属于可皂化的饱和酯类
难度: 中等查看答案及解析
-
关于 16O和18O的说法正确的是
A.16O与18O互为同分异构体
B.16O与18O核外电子排布不同
C.通过化学变化可以实现16O与18O间的转化
D.标准状况下,1.12L 16O2和1.12L18O2均含有0.1NA个氧原子
难度: 简单查看答案及解析
-
下列化学用语只能用来表示一种微粒的是
A.
B.
C.CH4O D.C
难度: 中等查看答案及解析
-
下列说法中正确的是
A.摩尔是可以把物质的质量与微观粒子数联系起来的一个基本物理量
B.0.012 kg 12C中所含的碳原子数为NA
C.物质的摩尔质量等于其相对分子(原子)质量
D.1mol任何物质都含有约6.02×1023个原子
难度: 简单查看答案及解析
-
下列金属防腐的措施中,使用外加电流的阴极保护法的是
A.水中的钢闸门连接电源的负极 B.金属护拦表面涂漆
C.枪炮的表面涂上一层机油 D.地下钢管连接镁块
难度: 简单查看答案及解析
-
已知钡的某种同位素是
,由学过的知识无法推断出的信息是
A.钡元素的相对原子质量 B.钡元素在周期表中的位置
C.钡原子的核电荷数 D.钡原子的核外电子排布
难度: 简单查看答案及解析
-
欲证明一瓶无色液体是纯水,可靠的实验方法是
A.测得其pH=7 B.电解时得到H2与O2的体积比为2:1
C.遇钠生成氢气 D.1.01× 105Pa时沸点为100℃
难度: 中等查看答案及解析
-
下列实验事实不能用勒沙特列原理解释的是

难度: 中等查看答案及解析
-
有五种饱和溶液①Ba(NO3)2 ②Ca(OH)2 ③NaAlO2 ④Na2CO3 ⑤NH3和NaCl,分别持续通入CO2,最终得到沉淀或析出晶体的是
A.①②③④⑤ B.②③④⑤ C.③④⑤ D.③④
难度: 简单查看答案及解析
-
已知如下两个热化学反应方程式:
下列说法错误的是
A.反应①、②都属于加成反应
B.1,3—环己二烯比苯稳定
C.反应①、②的热效应说明苯环中含有的并不是碳碳双键
D.反应①、②中的所有有机物均可使溴水褪色,但褪色原理不完全相同
难度: 中等查看答案及解析
-
将40℃的饱和硫酸铜溶液升温至50℃,或者温度仍保持在40℃而加入少量无水硫酸铜,在这两种情况下均保持不变的是
A.硫酸铜的溶解度 B.溶液的质量
C.溶液中溶质的质量分数 D.溶液中Cu
的数目
难度: 中等查看答案及解析
-
关于三种有机物叙述错误的是(—SH的性质类似于—OH)

A.都能发生酯化反应
B.都能与NaOH反应
C.甲的苯环上的一氯代物有4种
D.丙的分子式为C10H15ON,苯环上的一氯代物有3种
难度: 中等查看答案及解析
-
常温下,向Na2CO3溶液中逐滴滴入0.1mol/L盐酸,溶液的pH随着滴入盐酸溶液体积变化曲线如下图,则下列说法正确的是

A.a点时溶液pH=11.5,原因是:CO32-+2H2O → H2CO3+2OH-
B.a-b段发生反应为:CO32-+2H+→ CO2↑+H2O
C.b-c段发生反应为:HCO3-+H+→ CO2↑+H2O
D.c-d段发生反应为:H++OH-→ H2O
难度: 中等查看答案及解析
-
除去被提纯物质中的杂质,方案正确的是
编号
被提纯的物质
杂质
除杂试剂
除杂方法
A.
CO2 (g)
SO2(g)
饱和Na2CO3溶液、浓H2SO4
洗气
B.
NaCl(s)
KNO3(s)
AgNO3溶液
过滤
C.
苯
苯酚
浓溴水
过滤
D.
苯
甲苯
KMnO4(酸化),NaOH溶液
分液
难度: 简单查看答案及解析
-
元素周期表中短周期的一部分如图,关于X、Y、Z、W、Q说法正确的是

A.元素Y与元素Z的最高正化合价之和的数值等于9
B.原子半径的大小顺序为:W>Z>Y
C.离子半径的大小顺序为:W2->Y2->Z3+
D.W的气态氢化物的热稳定性和还原性均比Q强
难度: 中等查看答案及解析
-
碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间有如图所示关系,根据图示转化关系推测下列说法错误的是
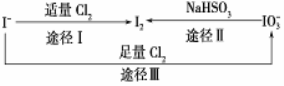
A.用KI淀粉试纸和食醋无法检验加碘盐中是否含有碘
B.足量Cl2能使湿润的KI淀粉试纸变白的原因可能是:5Cl2+I2+6H2O→2HIO3+10HCl
C.由图可知氧化性的强弱顺序为Cl2>IO3->I2
D.途径Ⅱ中若生成1 mol I2,反应中转移的电子数为10NA
难度: 中等查看答案及解析
-
向含S2—、Fe2+、Br—、I—各0.1mol的溶液中通入Cl2,通入Cl2的体积(标准状况)和溶液中相关离子的物质的量关系图正确的是

难度: 中等查看答案及解析
-
可用下图所示装置制取、干燥、收集并吸收多余气体的是
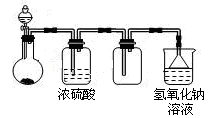
A.浓氨水与氧化钙固体反应制氨气
B.稀硫酸与硫化亚铁固体反应制硫化氢
C.浓盐酸与次氯酸钙固体反应制氯气
D.饱和食盐水与电石反应制乙炔
难度: 中等查看答案及解析
-
下表数据是对应物质的熔点,下列说法错误的是
编号
①
②
③
④
物质
AlF3
AlCl3
BCl3
NCl3
熔点/℃
1291
160
-107
-40
A.BCl3、NCl3分子中各原子最外层都满足8电子稳定结构
B.因为键长B-F< B-Cl,故BF3的熔点高于BCl3
C.AlF3、AlCl3都是强电解质,但晶体类型不同
D.BCl3为平面正三角形分子,故它是由极性键构成的非极性分子
难度: 中等查看答案及解析
-
25℃时,已知弱酸的电离常数:Ki(CH3COOH) = 1.8 ×10-5;Ki1(H2CO3) = 4.4 ×10-7;Ki2(H2CO3) = 4.7 × 10-11;Ki(HClO) = 4.0 ×10-8。则下列说法正确的是
A.物质的量浓度相等的溶液pH关系:pH(NaClO)>pH(Na2CO3)>pH(CH3COONa)
B.向NaClO溶液中通少量CO2:CO2 + NaClO + H2O → NaHCO3 + HClO
C.a mol/L HClO与b mol/L NaOH溶液等体积混合后所得溶液中c(Na+)>c(ClO-),则a一定小于b
D.向氯水中加入NaHCO3固体,可以增大氯水中次氯酸的浓度
难度: 中等查看答案及解析
-
有人曾建议用AG表示溶液的酸度,AG的定义为:AG=lg
,室温下实验室用0.01 mol/L的氢氧化钠溶液滴定20 mL相同浓度的醋酸溶液,滴定曲线如下图所示。下列有关叙述错误的是

A.A点时加入氢氧化钠溶液体积为20 mL
B.室温时0.01 mol/L的醋酸溶液pH=4
C.OA段溶液中:c(CH3COO-)> c(CH3COOH)
D.若B点时加入NaOH溶液40 mL,所得溶液中:c(CH3COO-)+2 c(CH3COOH) + c(H+) = c(OH-)
难度: 中等查看答案及解析
-
铁、铜混合粉末18.0g加入到100ml 5.0mol/LFeCl3溶液中,剩余固体质量为3.2g。下列说法正确的是
A.剩余固体是铁、铜混合物
B.原固体混合物中铜的质量是9.6g
C.反应后溶液中n(Fe3+)=0.10 mol
D.反应后溶液中n(Fe2+)+ n(Cu2+)=0.75 mol
难度: 中等查看答案及解析