-
CO2是温室气体,研究CO2的应用对促进低碳生活具有重要意义。
(1)1922年德国工业化生产尿素
Ⅰ:2NH3(g)+CO2(g)  NH2COONH4(s) ΔH1=-159.50kJ·mol-1
NH2COONH4(s) ΔH1=-159.50kJ·mol-1
Ⅱ:NH3COONH4(s)  CO(NH2)2(s)+H2O(g) ΔH2=+72.50kJ·mol-1
CO(NH2)2(s)+H2O(g) ΔH2=+72.50kJ·mol-1
①写出用NH3和CO2合成尿素总反应的热化学方程式_________;按照酸碱质子理论,能接受H+的物质为碱,现常温下溶液中存在反应:NH3+NH2COOH NH2COONH4(K=1×1010),则该溶液中碱性强弱为:NH3____NH2COONH4(填“强于”、“弱于”、“相等”或“不能确定”)。
NH2COONH4(K=1×1010),则该溶液中碱性强弱为:NH3____NH2COONH4(填“强于”、“弱于”、“相等”或“不能确定”)。
②在一个体积恒为1L的恒温密闭容器中充入2molCO2和4molNH3的混合气体,经历反应Ⅰ、Ⅱ合成CO(NH2)2,混合气体中的氨气体积分数及气体总浓度随时间变化如下图所示。

对于反应Ⅰ:A点的正反应速率与B点的逆反应速率的大小关系是:v _______v
_______v (填“>”“<”或“=”)。当温度升高时,平衡常数K1值的变化趋势为__________,在B点氨气的转化率为_________;
(填“>”“<”或“=”)。当温度升高时,平衡常数K1值的变化趋势为__________,在B点氨气的转化率为_________;
对于反应Ⅱ:从动力学分析,选用合适正催化剂可以使该反应活化能_______(“增大”“减小”或“不变”)
(2)利用二氧化碳制备乙烯
用惰性电极电解强酸性二氧化碳水溶液可得到乙烯,其原理如下图所示。

①b电极上的电极反应式为______________;
②该装置中使用的是___________(填“阴” 或“阳”)离子交换膜。
-
氯化亚铜广泛应用于有机合成。工业上以低品位铜矿(主要含CuS、Fe2O3、SiO2)为原料,
制备氯化亚铜的生产工艺如下:
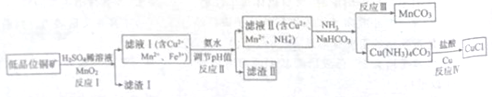
(1)CuS中Cu的化合价为_____________。
(2)滤渣Ⅰ的成分除S之外还有__________,反应Ⅰ中MnO2的作用是______________
(3)已知生成氢氧化物的pH如下表:
| 沉淀物 | Fe(OH)3 | Mn(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 2.7 | 8.3 | 4.2 |
| 完全沉淀的pH | 3.2 | 9.8 | 6.7 |
则反应Ⅱ中用氨水调节pH值的范围是________________。
(4)检验滤液Ⅱ中是否含有Fe3+的试剂是____________。
(5)请用化学用语回答:
①反应中Ⅲ生成难溶MnCO3的离子方程式_____________;
②反应Ⅳ素所对应的化学方程式____________________。
(6)氯化亚铜的定量分析:
步骤Ⅰ.称取0.2500g的样品和10.0mL 1.0mol/L的FeCl3溶液置于250mL锥形瓶中,不断摇动;
步骤Ⅱ.待样品溶解后,加水10.0mL和3滴指示剂;
步骤Ⅲ.用0.1000mol/L CeOSO4标准溶液滴至终点,并记录读数。重复实验两次,测得数据如下:
| 序号 | 1 | 2 | 3 |
| 起始读数 | 0.95mL | 0.70mL | 1.00mL |
| 终点读数 | 20.95mL | 24.95mL | 21.00mL |
已知:CuCl+FeCl3=CuCl2+FeCl2 Fe2++Ce4+=Fe3++Ce3+
①数据处理:计算CuCl纯度________________;
②误差分析:下列操作会使滴定结果偏高的是__________________。
A.锥形瓶中有少量蒸馏水
B.滴定终点读数时仰视滴定管刻度线,其他操作正确
C.0.1000mol/L CeOSO4溶液久置后浓度变小
D.滴定前滴定管尖嘴有气泡,滴定后气泡消失
E.所取FeCl3溶液体积偏大
-
铁、锌、镍、铬及其合金在现代社会中的用途越来越广泛。
(1)铁在元素周期表中的位置是_____________,基态铁原子有_________种不同运动状态的电子。
(2)镍可与CO形成配合物Ni(CO)n,CO分子中σ键与π键的个数比为________;该配合物中原子Ni的价层电子总数为18,则n=________,该配合物的熔点是170℃,则Ni(CO)n 属于__________
(3)在铬的摧化作用下,乙醇可被空气氧化为乙醛(CH3CHO),乙醛分子中碳原子的杂化方式是______,乙醛分子中H—C=O的键角_______(填“大于”、“等于”或“小于”)乙醇分子中的H—C—O的键角。乙醇和乙醛均极易溶于水,其主要原因是_______________。
(4)立方NiO晶体结构类似于NaCl,则Ni2+填入O2-构成的________空隙(填“正四面体”、“正八面体”、“立方体”或“压扁八面体”)。其晶胞边长为ɑ pm,列式表示NiO晶体的密度为____g/cm3(不必计算出结果,阿伏加德罗常数的值为NA)

2Mg+O2↑


先增大后减小
 (苯甲酸乙酯)+H2O
(苯甲酸乙酯)+H2O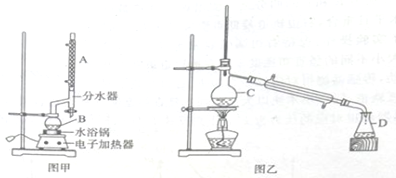




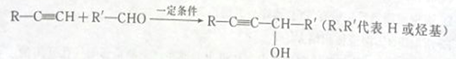
 _________________。
_________________。