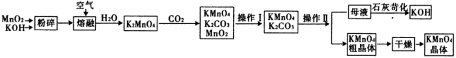
-
化学与生活、生产实际密切相关。下列有关说法不正确的是
A.光导纤维应避免在强碱环境中使用
B.船体镀锌或镀锡均可保护船体,镀层破损后将立即失去保护作用
C.部分卤代烃可用作灭火剂
D.油脂皂化生成的高级脂肪酸钠是肥皂的有效成分
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.一定条件下,将1mol N2和3mol H2混合,充分反应后转移的电子数为6NA
B.6.4g由S2、S4、S8组成的混合物含硫原子数为0.2NA
C.11g超重水(T2O)含中子数为5NA
D.常温常压下,11.2L Cl2含氯原子数为NA
难度: 困难查看答案及解析
-
已知在浓H2SO4存在并加热至170℃的过程中,2个乙醇分子在羟基上可发生分子间脱水反应生成
醚,
如 CH3CH2—OH+HO—CH2CH3
CH3CH2—O—CH2CH2+H2O。用浓 H2SO4跟分子式分别为CH4O和C3H8O的醇的混合液在一定条件下脱水,可得到的有机物的种类有
A.5种 B.6种 C.7种 D.8种
难度: 困难查看答案及解析
-
在短周期元素中,X元素与 Y、Z、W三元素相邻,X、Y的原子序数之和等于 Z的原子序数,这四种元素原子的最外层电子数之和为 20。下列判断正确的是
A. 四种元素均可与氢元素形成 18电子分子
B. X、Y、Z、W形成的单质最多有 6种
C. 四种元素中,Z的最高价氧化物对应水化物酸性最强
D. 四种元素的原子半径:rZ>rX>rY>rW
难度: 中等查看答案及解析
-
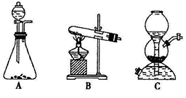
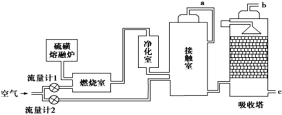
关于下列各实验装置图的叙述中,正确的是
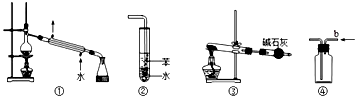
A.装置①可用于分离苯和溴苯的混合物
B.装置②可用于吸收 HCl或 NH3气体
C.装置③可用于分解 NH4Cl制备NH3
D.装置④b口进气可收集CO2或NO气体
难度: 中等查看答案及解析
-
H2C2O4水溶液中H2C2O4、HC2O4-和 C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示[已知Ksp(CaC2O4)=2.3×10-9].下列说法正确的是( )
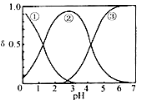
A.曲线①代表的粒子是HC2O4-
B.0.1 mol•L-1 NaHC2O4溶液中:c(C2O42
-)>c(H2C2O4)
C.pH=5时,溶液中主要含碳物种浓度大小关系为:c(C2O42-)>c(H2C2O4)>c(HC2O4-)
D.一定温度下,往 CaC2O4饱和溶液中加入少量CaCl2固体,c(C2O42-)将减小,c(Ca2+)不变
难度: 困难查看答案及解析
-
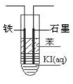
某小组同学用如图所示装置研究电化学原理。下列关于该原电池的说法不正确的是

A.原电池的总反应为 Fe+Cu2+=Fe2++Cu
B.反应前,电极质量相等,一段时间后,两电极质量相差12 g,导线中通过0.2 mol电子
C.其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为2H++2e-=H2↑
D.盐桥中是 KNO3溶液,则盐桥中NO3-移向乙烧杯
难度: 中等查看答案及解析