-
在恒温下密闭容器内发生反应 P(g)+Q(g)⇌R(g)+S(g)已达到平衡的是( )
A.反应容器内的压强不随时间改变
B.反应容器内P、Q、R、S四者浓度之比为1:1:1:1
C.P的生成速率和S的生成速率相等
D.反应容器内的气体总物质的量不随时间变化难度: 中等查看答案及解析
-
用铂电极电解下列溶液,阴极和阳极上的主要产物为分别为H2和O2的是( )
A.稀NaOH溶液
B.HCl溶液
C.CuSO4溶液
D.酸性AgNO3溶液难度: 中等查看答案及解析
-
下列反应的能量变化与其它三个不相同的是( )
A.铝粉与氧化铁的反应
B.氯化铵与消石灰的反应
C.锌片与稀硫酸反应
D.钠与冷水反应难度: 中等查看答案及解析
-
下列说法正确的是( )
A.所有放热反应都是自发反应
B.铁在潮湿空气中生锈是自发过程
C.熵增的反应都是自发反应
D.电解池反应均属于自发反应难度: 中等查看答案及解析
-
已知450℃时,反应H2(g)+I2(g)⇌2HI(g)的K=50,由此推测在450℃时,反应 2HI(g)⇌H2(g)+I2(g)的化学平衡常数为( )
A.50
B.0.02
C.100
D.无法确定难度: 中等查看答案及解析
-
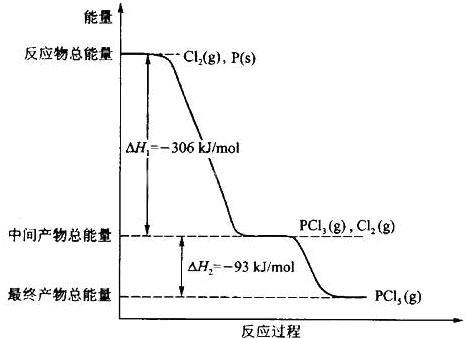
由金红石(TiO2)制取单质Ti,涉及到的部分步骤为:
TiO2→TiO4Ti
已知:①C(s)+O2(g)=CO2(g)△H1
②2CO(g)+O2(g)=2CO2(g)△H2
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g)△H3
则反应TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H为( )
A.△H3+2△H1-2△H2
B.△H3+△H1-△H2
C.△H3+2△H1-△H2
D.△H3+△H1-2△H2难度: 中等查看答案及解析
-
汽车尾气净化中的一个反应如下:NO(g)+CO(g)⇌
N2(g)+CO2(g)△H=-373.4kJ•mol-1.在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
镍镉(Ni-Cd)可充电电池在现代生活中有广泛的应用.它的充放电反应按式进行:Cd(OH)2+2Ni(OH)2
Cd+2NiO(OH)+2H2O.由此可知,该电池放电时的负极材料是( )
A.Cd(OH)2
B.Ni(OH)2
C.NiO(OH)
D.Cd难度: 中等查看答案及解析
-
已知:①C(石墨,s)=C(金刚石,s)△H=Q kJ•mol-1(Q>0)②在稀溶液中,H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ•mol-1,下列有关说法正确的是( )
A.金刚石比石墨稳定
B.石墨比金刚石稳定
C.浓硫酸与氢氧化钠溶液反应生成1molH2O时放出的热量也为57.3kJ
D.1mol醋酸与1mol氢氧化钠的稀溶液混和反应完全放出的热量等于57.3kJ难度: 中等查看答案及解析
-
已知:2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1,CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ•mol-1,现有H2与CH4的混合气体112L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3695kJ,则原混合气体中H2与CH4的物质的量之比是( )
A.1:1
B.1:3
C.1:4
D.2:3难度: 中等查看答案及解析
-
铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,不正确的是( )

A.正极电极反应式为:2H++2e-→H2↑
B.此过程中还涉及反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3
C.此过程中铜不被腐蚀
D.此过程中电子从Fe移向Cu难度: 中等查看答案及解析
-
在一密闭容器中,反应 aA(气)⇌bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
A.平衡向正反应方向移动了
B.物质A的转化率减少了
C.物质B的质量分数增加了
D.a>b难度: 中等查看答案及解析
-
在下列各说法正确的是( )
A.对于2SO2(g)+O2(g)⇌2SO3(g)△H=-QkJ/mol,(Q>0)若向一密闭容器中加入1molSO2和5molO2充分反应后,放出的热量为0.5QkJ
B.热化学方程式中的化学计量数表示相应物质的物质的量,不能用分数表示
C.需要加热才能发生的反应不一定是吸热反应
D.对于C(s)+H2O(g)⇌CO(g)+H2(g)△H>0反应前后熵不变难度: 中等查看答案及解析
-
下列说法正确的是( )
A.电解MgCl2饱和溶液,可制得金属镁
B.蓄电池充电时,其负极应与电源的正极相连
C.在轮船外连接锌块保护外壳不受腐蚀是采用了牺牲阳极保护法
D.纯银器在空气中露置其表面因电化学腐蚀渐渐变暗难度: 中等查看答案及解析
-
下列对化学平衡移动的分析中,不正确的是( )
①已达平衡的反应C(s)+H2O(g)⇌CO(g)+H2(g),当增加反应物物质的量时,则平衡向正反应方向移动;
②已达平衡的反应N2(g)+3H2(g)⇌2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率升高;
③有气体参加的反应平衡时,若减小反应器容积时,平衡一定向气体总物质的量增大的方向移动;
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动.
A.①④
B.①②③
C.②③④
D.①②③④难度: 中等查看答案及解析
-
在下列说法正确的是( )
A.镁、铝和NaOH溶液所形成的原电池中,镁作正极
B.用电解法精炼粗铜时,粗铜作阴极
C.电镀时,镀件作阳极,含有镀层金属阳离子的溶液作电镀液
D.电解质溶液的导电过程就是该溶液的电解过程难度: 中等查看答案及解析
-
在相同温度和压强下,对反应CO2(g)+H2(g)⇌CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见表:
上述四种情况达到平衡后,n(CO)的大小顺序是( )CO2 H2 CO H2O 甲 a mol a mol 0 mol 0 mol 乙 2a mol a mol 0 mol 0 mol 丙 0 mol 0 mol a mol a mol 丁 a mol 0 mol a mol a mol
A.丁>乙>丙=甲
B.乙>丁>甲>丙
C.乙=丁>丙=甲
D.丁>丙>乙>甲难度: 中等查看答案及解析
-
如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是( )
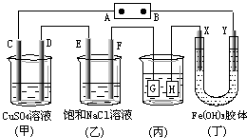
A.电源B极是正极
B.(甲)、(乙)装置的C、D、E、F电极均有单质生成,其物质的量之比为1:2:2:2
C.欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液
D.装置(丁)中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷难度: 中等查看答案及解析