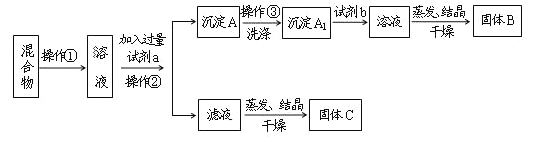
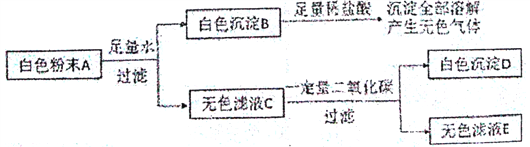
-
胶体区别于其它分散系的本质是( )
A. 胶体的分散质粒子直径在1 nm~100nm之间
B. 胶体粒子带电荷并且在一定条件下能稳定存在
C. 胶体粒子不能穿过半透膜,能通过滤纸空隙
D. 胶体粒子能够发生布朗运动而且能产生丁达尔现象
难度: 简单查看答案及解析
-
实验室中的药品常按物质的性质、类别等不同而有规律地放置。在做“酸的性质”实验时,实验桌上部分药品的摆放如下图所示。某同学取用KOH溶液后应把它放回的位置是( )

A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列实验操作中正确的是( )
A.蒸发操作时,应使混合物中的水分完全蒸干后才能停止加热
B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶支管口处
C.分液操作时,分液漏斗中下层液体从下口放出后,再将上层液体从下口放出到另一个烧杯
D.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
难度: 简单查看答案及解析
-
通过加入过量的化学药品,采用恰当的分离混合物的方法,除去某溶液里溶解的杂质。下列做法中正确的是(括号内的物质为杂质)( )
A. 氯化钠溶液(氯化钡):加硫酸钠溶液,过滤
B. 硝酸钾溶液(硝酸银):加氯化钠溶液,过滤
C. 氯化钠溶液(单质碘):加酒精,分液
D. 硝酸钾溶液(单质碘):加四氯化碳,分液
难度: 简单查看答案及解析
-
下列说法正确的是 ( )
A. SO2的摩尔质量为64g
B. 气体的摩尔体积约为22.4L/mol
C. 12g12C中所含碳原子数即为阿伏加德罗常数
D. 4gNaOH溶于1L水所得溶液的物质的量浓度为0.1mol/L
难度: 简单查看答案及解析
-
某气体的质最是14.2g,标准状况下的体积是4.48L,该气体的摩尔质量是
A. 28.4 B. 28.4g/mol C. 71 D. 71 g/mol
难度: 中等查看答案及解析
-
将5mol/L的Mg(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO3-的物质的量浓度为
A.
mol/L B.
mol/L C.
mol/L D.
mol/L
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A. 标准状况下,22.4L水中所含的分子数约为6.02×1023个
B. 1molCl2中含有的原子数为NA
C. 标准状况下,aL氧气和氮气的混合物含有的分子数约为
个
D. 常温常压下,11.2LCO分子数是0.5NA
难度: 中等查看答案及解析
-
某硝酸的物质的量浓度为c mol/L,溶质的质量分数为a%,则此溶液的密度(g/cm3)为
A.
B.
C.
D.
难度: 中等查看答案及解析
-
科学家发现一种新型分子,其化学式为H3。相同条件下,等质量的H3和H2具有相同的
A. 原子数 B. 分子数 C. 体积 D. 物质的量
难度: 中等查看答案及解析
-
由CO2、H2和CO组成的混合气体在同温同压下与氮气的密度相同。则该混合气体中CO2、H2和CO的体积比为
A. 29∶8∶13 B. 22∶1∶14 C. 13∶8∶29 D. 44∶2∶28
难度: 简单查看答案及解析
-
利用实验器材(规格和数量不限)能完成相应实验的一项是( )
选项
实验器材(省略夹持装置)
相应实验
A
烧杯、玻璃棒、蒸发皿
CuSO4溶液的浓缩结晶
B
烧杯、玻璃棒、胶头滴管、滤纸
用盐酸除去BaSO4中少量BaCO3
C
烧杯、玻璃棒、胶头滴管、容量瓶
用NaCl配制0.5mol/L的溶液
D
烧杯、玻璃棒、胶头滴管、分液漏斗
用溴水和CCl4除去NaBr溶液中少量NaI
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
已知一个SO2分子的质量是a 克,一个SO3分子的质量是b克,若以硫的1/100作为标准,则SO2的摩尔质量是( )g/mol
A. 100a/(b-a) B. 100a/(3a-2b) C. 100b/(3a-2b) D. 100a/(3b-2a)
难度: 中等查看答案及解析