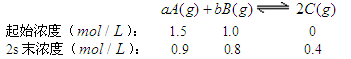-
下列反应中,既属于氧化还原反应同时又是吸热反应的是
A.Ba(OH)2.8H2O与NH4Cl反应 B.铝与稀盐酸
C.灼热的炭与CO2反应 D.甲烷与O2的燃烧反应
难度: 中等查看答案及解析
-
2011年3月17日,因日本福岛第一核电站发生核辐射泄漏事故牵动了全世界。我国出现了抢购碘盐的事件,这是因为人们认为食用碘可以防止释放的放射性物质碘-131对人体的影响。已知核辐射中放射性碘(碘-131)的核电荷数为53。请根据你所学过的知识判断下列说法正确的是
A.碘-131是碘的同素异形体
B.碘127I原子和碘131I原子的质子数不同
C.核能的利用证实原子的可分性
D.加碘食盐中含有适量的碘单质,大量食用含碘食盐对人体有益
难度: 中等查看答案及解析
-
不同的化学反应有不同的反应速率,决定化学反应速率的主要因素是
A.反应物的性质 B.温度 C.浓度 D.催化剂
难度: 中等查看答案及解析
-
下列化学用语正确的是
A.氯化氢的电子式
B.镁的原子结构示意图
C.次氯酸的结构式 H-Cl-O
D.碳酸钠的电离方程式 Na2CO3=Na+ + CO32—
难度: 中等查看答案及解析
-
下列说法中,正确的是
A. 在Na、P、Cl 、Ar四种元素中,最高正化合价数值最大的是P
B. 在N、F、Mg、Cl四种元素中,原子半径最小的是Mg
C. 原子序数从3—10的元素,随着核电荷数的递增,原子的最外层电子数递增
D. SiH4(硅烷)比CH4稳定
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数,下列有关说法正确的是
A.0.5 mol苯分子中含有C=C双键数为1.5NA
B.1 mol甲基(—CH3)所含的电子总数为10NA
C.常温常压下,2.24L正戊烷、异戊烷及新戊烷的混合物,含C-H数目为1.2 NA
D.2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA
难度: 中等查看答案及解析
-
下列说法中正确的一组是
A.H2和D2互为同位素
B.
互为同分异构体
C.正丁烷和异丁烷是同系物
D.
是同一种物质
难度: 中等查看答案及解析
-
下列分子式表示的物质,具有同分异构体的是
A.C3H7Cl B.C3H8 C.CH2Cl2 D.CH4O
难度: 中等查看答案及解析
-
已知H+ +OH- = H2O生成1 mol H2O放出热量57.3 kJ,下列反应中放出57.3 kJ热量的是
A.1 mol稀H2SO4与足量NaOH溶液反应
B.稀盐酸与氨水反应生成1 mol H2O
C.稀盐酸与稀Ba(OH)2溶液反应生成1 mol水
D.稀NaOH与98.3%硫酸生成1 mol水
难度: 中等查看答案及解析
-
下列说法中正确的是
A.化学键只能使原子相结合, 不能使离子相结合.
B.化学键的断裂和形成是化学反应中能量变化的主要原因.
C.烷烃CH3(CH2)3CH3沸点比(CH3)2CHCH2CH3的低
D.天然气﹑石油和水煤气分别属于化石能源﹑可再生能源和二次能源.
难度: 中等查看答案及解析
-
加成反应是有机化学中的一类重要的反应,下列属于加成反应的是
A.乙烯与溴的四氯化碳溶液反应 B.将苯滴入溴水中,振荡后水层接近无色
C.乙烯使酸性KMnO4溶液褪色 D.甲烷与Cl2混合,光照后黄绿色消失
难度: 中等查看答案及解析
-
下列叙述正确的是
①在盛有硝酸银的烧杯中放入用导线连接的铜片和银片,正极质量不变。
②相邻的同系物分子组成上相差一个CH2原子团
③丙烯分子中三个碳原子在同一平面上 ,其一氯代物只有2种
④由ⅠA族和ⅥA族短周期元素形成的原子个数比为1∶1,电子总数为38的化合物,是含有共价键的离子型化合物
⑤等物质的量乙烷与氯气在光照条件下反应,可用这个方法制取一氯乙烷。
A.①③ B.②⑤ C.①③ D.②④
难度: 中等查看答案及解析
-
如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是
2011.3.18, 实验后的记录:
①Cu为负极,Zn为正极
②Cu极上有气泡产生,发生还原反应
③
向Cu极移动
④若有0.5mol电子流经导线,则可产生0.25mol气体
 ⑤电子的流向是:Cu―→Zn
⑤电子的流向是:Cu―→Zn⑥正极反应式:Cu+2e-===Cu2+,发生氧化反应
A.①②③ B.②④ C.②④⑥ D.③④⑤
难度: 中等查看答案及解析
-
下列措施是为了降低化学反应速率的是( )
A.把石灰石固体研细后与盐酸反应
B.用MnO2作H2O2分解反应的催化剂
C.食品放在冰箱中贮藏
D.铝和烧碱溶液反应时,稍微加热
难度: 中等查看答案及解析
-
将4 mol A 气体和2 mol B 气体在2 L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)
2C(g)若经2 s 后测得C的浓度为0.6 mol/L,现有下列几种说法,其中正确的是( )
①用物质A表示的反应的平均速率为0.3 mol/(L·s)
②用物质B表示的反应的平均速率为0.6 mol/(L·s)
③反应达到平衡时,A、B、C的反应速率一定相等
④反应达到平衡时,A、B、C的物质的量均不再变化
A.①③ B.①④ C.②③ D.③④
难度: 中等查看答案及解析
-
下列说法正确的是
A.SiCl4、PCl5分子中各原子最外层均达到8电子稳定结构
B.化学反应中能量变化的大小与反应物的质量多少无关。
C.经实验测得邻-二溴苯仅一种结构,说明苯环结构中,不存在单双键交替结构
D.需要加热才能发生的反应一定是吸热反应
难度: 中等查看答案及解析