-
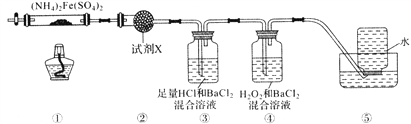
在有机化学中,硫酰氯(SO2Cl2)长用作氯化剂和氯磺化剂,在染料、药品、除草剂和农用杀虫剂的生产过程中有重要作用。现在拟用干燥的Cl2和SO2在活性炭催化下制取硫酰氯。反应的化学方程式为:SO2(g)+ Cl2(g) =SO2Cl2(l) ΔH =−97.3 kJ·mol−1,实验装置如图所示(部分夹持装置未画出)。
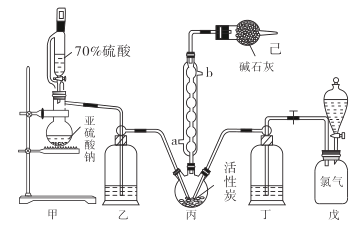
已知:硫酰氯通常条件下为无色液体,熔点−54.1℃,沸点69.1℃。在潮湿空气中“发烟”;100°C以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解。
回答下列问题:
(1)装置丙中作为反应容器的仪器的名称为_______,装置丙中球形冷凝管的作用是________;如何控制两种反应物体积相等:____________________________________。
(2)装置戊上方分液漏斗中最好选用下列试剂:_________________(选填字母)
A.蒸馏水 B.饱和食盐水 C.浓氢氧化钠溶液 D.6.0 mol·L-1盐酸
(3)若缺少装置己,硫酰氯(SO2Cl2)会和空气中的水反应而变质,其化学方程式是______________________________。
(4)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯:2ClSO3H SO2Cl2 + H2SO4,分离两种产物的方法是_____________(选填字母)。
SO2Cl2 + H2SO4,分离两种产物的方法是_____________(选填字母)。
A.重结晶 B.过滤 C.蒸馏 D.萃取
(5)长期储存的硫酰氯会发黄,可能的原因是_________________________________(用化学方程式和必要的文字加以解释)。
(6)若反应中消耗的氯气体积为896 mL(标准状况下),最后经过分离提纯得到4.05 g纯净的硫酰氯,则硫酰氯的产率为___________。
(7)请设计实验方案检验产品中有硫酸(可选试剂:稀盐酸、稀硝酸、BaCl2溶液、蒸馏水、石蕊溶液):___________________________。
-
辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下所示:
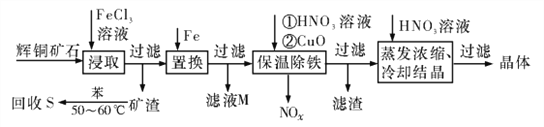
(1)写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:________________________
(2)“矿渣”中除了S以外,还有____________(填化学式);“回收S”过程中温度控制在50~60℃之间,不宜过高或过低的原因是____________________________________
(3)“保温除铁”过程中,加入CuO的目的是____________________________________;“蒸发浓缩、冷却结品”过程中,要用HNO3溶液调节溶液的pH,其理由是____________
(4)气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为________________________;向“滤液M”中加入(或通入) ____________(填母代号),可得到另一种流程中可循坏利用的物质。
a.铁 b.氯气 c.高锰酸钾
-
TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:

资料:TiCl4及所含杂质氯化物的性质
| 化合物 | SiCl4 | TiCl4 | AlCl3 | FeCl3 | MgCl2 |
| 沸点/℃ | 58 | 136 | 181(升华) | 316 | 1412 |
| 熔点/℃ | −69 | −25 | 193 | 304 | 714 |
| 在TiCl4中的溶解性 | 互溶 | —— | 微溶 | 难溶 |
(1)氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g) ΔH1=+175.4 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-220.9 kJ·mol-1
① 沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:____________________。
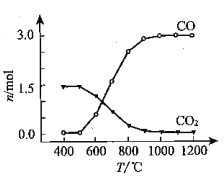
② 氯化过程中CO和CO2可以相互转化,根据如图判断:CO2生成CO反应的ΔH_____0(填“>”“<”或“=”),判断依据:_______________。
③ 氯化反应的尾气须处理后排放,尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是__________________________。
④ 氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有_____________。
(2)精制过程:粗TiCl4经两步蒸馏得纯TiCl4。示意图如下:
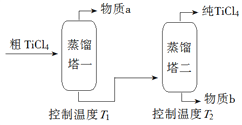
物质a是______________,T2应控制在_________。
-
元素周期表中,除了22种非金属元素外,其余的都是金属,请根据元素周期表回答下列问题:
I.(1)基态氮原子核外共有_______种运动状态不相同的电子,该原子核外电子排布中电子在能量最低的轨道呈_______形,用n表示能层,氟元素所在族的外围电子排布式为______________。
(2)在元素周期表中,某些主族元素与下方的主族元素的性质有些相似,被称为“对角线规则”,如下表:
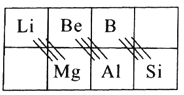
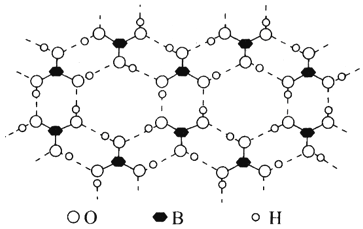
根据“对角线规则”写出Be(OH)2与NaOH反应的离子方程式______________,硼酸(H3BO3)是一种具有片层结构的白色晶体,层内的H3BO3分子间通过氢键相连(如图)。含1mol H3BO3的晶体中有__________mol氢键,H3BO3中B原子的杂化类型为_____________。
(3)以第二周期为例,除Be、N外,其它元素的第一电离能从左到右逐渐增大的原因是____________________________________________________。
II.近年来铁及其化合物在工农业中有广阔的应用前景。
(4)铁的一种络离子[Fe(CN)6]4-中Fe2+的配位数为6,该络离子中不存在______(填序号)。
A.共价键 B.非极性键 C.配位键 D.δ键 E.π键
(5)AlCl3的熔点比NaCl熔点低的原因是____________________________________。
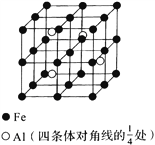
(6)一种Al-Fe合金的立体晶胞如图所示。若晶体的密度为ρ g∙cm-3,则此合金中最近的两个Fe原子之间的距离为__________cm(用含ρ的代数式表示)。
-
药物Targretin(F)能治疗顽固性皮肤T—细胞淋巴瘤,其合成路线如下图所示:
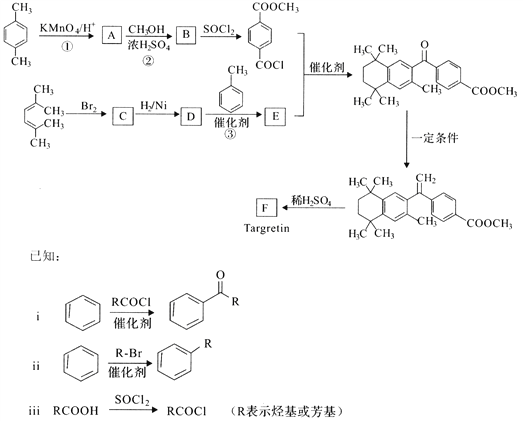
(1)反应①的反应类型是______________。
(2)反应②的化学方程式:__________________________________________。
(3)C的核磁共振氢谱图中有______________个峰。
(4)反应③的化学方程式:__________________________________________。
(5)F的分子式是C24H28O2. F中含有的官能团:__________________________。
(6)写出满足下列条件A的两种同分异构体的结构简式(不考虑—O—O—或 结构):_______________________________________________________________。
结构):_______________________________________________________________。
a.苯环上的一氯代物有两种 b.既能发生银镜反应又能发生水解反应
(7)已知: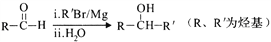 。以2-溴丙烷和乙烯为原料,选用必要的无机试剂合成
。以2-溴丙烷和乙烯为原料,选用必要的无机试剂合成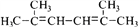 合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)________。
合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)________。

+
=Fe2O3+5H2O

的值不断增大









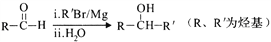 。以2-溴丙烷和乙烯为原料,选用必要的无机试剂合成
。以2-溴丙烷和乙烯为原料,选用必要的无机试剂合成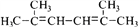 合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)________。
合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)________。