-
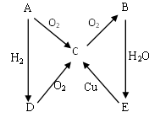
C、N、S是重要的非金属元素,下列说法正确的是( )
A.三种元素均可以和氧元素形成2种或2种以上氧化物
B.实验室用铜和浓硝酸反应制取NO
C.CO2、SO2、NO2都能与H2O反应,且原理相同
D.稀硫酸、稀硝酸与铁的反应均属于置换反应
难度: 中等查看答案及解析
-
下列有关说法不正确的是 ( )
A.常温下干燥的Cl2能用钢瓶贮运
B.检验HCl气体中是否混有Cl2,方法是将气体通入硝酸银溶液
C.自然界中不存在游离态硅
D.HF溶液不能贮存在磨口玻璃塞的试剂瓶中
难度: 中等查看答案及解析
-
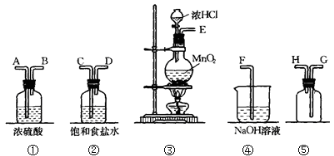
下列装置所示的实验中,能达到实验目的的是( )

难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.Ca(HCO3)2溶液与少量Ca(OH)2溶液反应:2HCO+Ca2++2OH-===CaCO3↓+2H2O+CO32-
B.向NaClO溶液中通入少量SO2:2ClO-+SO2+H2O===2HClO+SO
C.Cl2通入水中:Cl2+H2O===2H++Cl-+ClO-
D.用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2===2NH+SO+H2O
难度: 中等查看答案及解析
-
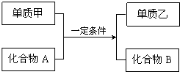
下列一步转化中,一定要加入氧化剂才能实现的是( )
A.SiO2→Na2SiO3 B.Na2O2→NaOH C.NH3→NO D.N2→NH3
难度: 中等查看答案及解析
-
下列说法正确的有几项( )
①pH≤5.6的降水称酸雨;②NO2是HNO3的酸酐;③硅酸凝胶即为硅胶;④干燥的氯气也有漂白性;⑤常温下可以用铁桶盛装浓硝酸;⑥Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性
A.1 B.2 C.3 D.4
难度: 中等查看答案及解析
-
NA为阿伏伽德罗常数的数值,下列叙述错误的有几个( )
①常温常压下,8 g O2含有4NA个电子
②标准状况下,11.2 L氦气中含有0.5 NA个原子
③标准状况下,0.1 mol Cl2参加反应,转移的电子数目一定为0.2 NA
④1 L 0.1 mol·L-1的氨水中有NA个NH4+
⑤1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,转移电子总数2NA
A.2个 B.3个 C.4个 D.5个
难度: 中等查看答案及解析
-
已知:2HI+Cl2===2HCl+I2,I2为固体。常温常压下,两个容积相同的烧瓶中分别盛满X和Y两种气体,打开开关a,两烧瓶内的气体充分混合后,容器内的压强由大到小的顺序正确的是 ( )
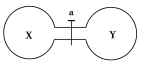
A.②>③>①>④ B.③>①=④>②
C.③>①>④>② D.④>①>②>③
难度: 中等查看答案及解析
-
下列离子在指定溶液中可以大量共存的是 ( )
A.在饱和氯水中:Cl-、NO3-、Na+、SO32-
B.0.1mol/L NaAlO2溶液中:K+、CO32-、SO42-、Cl-
C.在强碱性溶液中:Na+、NH4+、SO32-、Cl-
D.1.0 mol·L-1的盐酸溶液中:K+、Fe2+、ClO-、SO42-
难度: 中等查看答案及解析
-
现有24 mL浓度为0.05 mol·L-1的Na2SO3溶液恰好与20 mL某浓度的K2Cr2O7溶液完全反应。已知Na2SO3可被K2Cr2O7氧化为Na2SO4,元素Cr在还原产物中的化合价为+3价,则K2Cr2O7溶液的浓度为( )
A.0.01 mol·L-1 B.0.02 mol·L-1 C.0.03 mol·L-1 D.0.04 mol·L-1
难度: 中等查看答案及解析
-
下列叙述错误的是 ( )
A.检验NH时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体
B.液氨汽化时要吸收大量的热,可用作制冷剂
C.实验室用NH4Cl和Ca(OH)2制备NH3涉及氧化还原反应
D.将分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水
难度: 中等查看答案及解析
-
在下列条件下,两种气体的分子数一定相等的是 ( )
A.同密度、同压强的N2和C2H4 B.同温度、同体积的O2和N2
C.同体积、同密度的C2H4和CO D.同压强、同体积的O2和N2
难度: 中等查看答案及解析
-
某溶液可能含有Cl-、SO、CO、NH、Fe3+、Al3+和K+。取该溶液100 mL,加入过量NaOH溶液,加热,得到0.02 mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6 g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。由此可知原溶液中 ( )
A.至少存在5种离子 B.Cl-一定存在,且c(Cl-)≥0.4 mol·L-1
C.SO、NH一定存在,Cl-可能不存在 D.CO、Al3+一定不存在,K+可能存在
难度: 中等查看答案及解析
-
下列有关硝酸化学性质的叙述中,正确的是 ( )
A.敞口放置的浓硝酸浓度变小是因为浓硝酸的吸水性
B.硝酸可与Na2SO3反应制得SO2气体
C.浓硝酸因分解放出的NO2又溶解于硝酸而呈黄色
D.硝酸能与Fe2O3反应,表现氧化性
难度: 中等查看答案及解析
-
有关溶液中所含离子的检验,下列判断正确的是 ( )
A.加入氯水,再滴加KSCN溶液后有红色物质生成,则原溶液中一定有Fe3+存在
B.加入盐酸有能使澄清石灰水变浑浊的气体生成,则原溶液中一定有大量的CO32-存在
C.用某溶液做焰色反应实验时火焰为黄色,则该溶液中一定有钠元素,可能有钾元素
D.分别含有Mg2+、Cu2+、Fe2+和Na+的四种盐溶液,只用NaOH溶液是能一次鉴别开的
难度: 中等查看答案及解析
-
下列实验过程中,始终无明显现象的是( )
A.NO2通入FeSO4溶液中 B.CO2通入CaCl2溶液中
C.NH3通入AlCl3溶液中 D.SO2通入已酸化的Ba(NO3)2溶液中
难度: 中等查看答案及解析
-
浓度均为0.1 mol·L-1的三种溶液等体积混合,充分反应后没有沉淀的一组溶液是( )[
A.BaCl2 NaOH NaHCO3 B.Na2CO3 MgCl2 H2SO4
C.AlCl3 NH3·H2O NaOH D.Ba(OH)2 CaCl2 Na2SO4
难度: 中等查看答案及解析
-
将a g Fe2O3、Al2O3样品溶解在过量的200 mL浓度为0.1 mol·L-1的盐酸溶液中,然后向其中加入NaOH溶液,使Fe3+、Al3+刚好完全沉淀,用去NaOH溶液100 mL,则NaOH溶液的浓度为( )
A.0.1 mol·L-1 B.0.2 mol·L-1 C.0.4 mol·L-1 D.0.8 mol·L-1
难度: 中等查看答案及解析