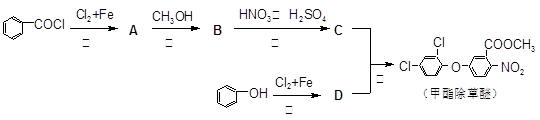
-
化学与生活息息相关,下列说法正确的是
A.XX化妆品从纯天然植物中提取,不含任何化学物质
B.自行车钢架生锈通常是电化学腐蚀所致
C.淀粉、油脂和蛋白质都是高分子化合物
D.医用酒精的浓度通常是95%
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数,下列说法正确的是
A.2.3 g金属钠与过量的氧气反应,无论加热与否转移电子数均为0.1NA
B.1mol Na2CO3晶体中含CO2- 3离子数小于1 NA
C.惰性电极电解食盐水,若线路中通过1 NA电子,则阳极产生气体11.2L
D.0.1 mol的CaO2中含阴离子数是0.2 NA
难度: 中等查看答案及解析
-
下图是某燃煤发电厂处理废气的装置示意图。下列说法错误的是
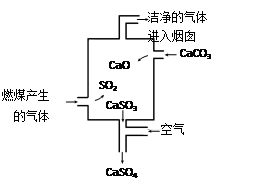
A.使用此废气处理装置可减少酸雨的形成
B.装置内发生的反应有化合、分解、置换和氧化还原反应
C.整个过程的总反应可表示为:2SO2+2CaCO3+O2=2CaSO4+2CO2
D.若烟囱的气体排放不达标,则此气体可使酸性高锰酸钾溶液褪色
难度: 中等查看答案及解析
-
碘盐的主要成分是KIO3和NaCl,KIO3在工业上可用电解法制取,以石墨和铁为电极,电解KI溶液,反应方程式为KI+3H2O=KIO3 +3H2↑。下列有关说法中正确的是
A.电解时,石墨作阴极,铁作阳极
B.电解时,在阴极上产生KIO3
C.电解后电解质溶液pH变大
D.电解中每转移0.6mol e-,理论上可得到0.1mol无水KIO3晶体
难度: 中等查看答案及解析
-
下列各溶液中,微粒的物质的量浓度关系错误的是
A.0.1 mol·L-1 NH4Cl溶液:c(NH4+)<c( Cl-)
B.0.1 mol·L-1 Na2CO3溶液:c(Na+)=2c(HCO3-)+2c(CO32¯)+2c(H2CO3)
C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:
c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D.常温下,将醋酸钠、盐酸两溶液混合呈中性的溶液中:c(Na+)>c( Cl-)=c(CH3COOH)
难度: 极难查看答案及解析
-
PCl3和PCl5都是重要的化工原料。将PCl3(g)和Cl2(g)充入体积不变的2 L密闭容器中,在一定条件下发生反应,在10 min时达到平衡:PCl3(g)+Cl2(g)
PCl5(g)。有关数据如下:
PCl3(g)
Cl2(g)
PCl5(g)
初始浓度/(mol/L)
2.0
1.0
0
平衡浓度/(mol/L)
c1
c2
0.4
下列判断错误的是
A.10 min内,v(Cl2)=0.04 mol/(L·min)
B.当反应达到平衡时,容器中Cl2为1.2 mol
C.若升高温度反应的平衡常数减小,则平衡时PCl3的转化率变大
D.平衡后再加入2.0 mol PCl3,在相同条件下再达平衡时,c(PCl5)<1.0mol/L
难度: 困难查看答案及解析
-
某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。进行如下实验:

下列有关说法正确的是
A.步骤I中减少的3g固体一定是混合物
B.步骤II中质量减少的物质一定是Cu
C.根据步骤I、II可以判断混合物X的成分为Al2O3、Fe2O3、Cu、SiO2
D.根据上述步骤II可以得出m(Fe2O3)∶m(Cu)=1∶1
难度: 中等查看答案及解析