-
2012年1月15日广西龙江河河水中镉(
Cd)含量超标约80倍,长达100-公里的河水受到严重污染,用于降污的主要药品是聚氯化铝[Al2(OH)nCl(6-n)]m],聚氯化铝不像硫酸铝那样有固定的分子式,下列说法不正确的是
A.
Cd原子的中子数为64 B.聚氯化铝能降污是因为它有强氧化性
C.聚氯化铝是混合物 D.镉的单质有导电性和延展性
难度: 中等查看答案及解析
-
下列说法正确的是
A.珍珠、玛瑙、红宝石、水晶的主要成分都是硅酸盐
B.工业上冶炼金属Mg、Cu都采用热还原法
C.氯水、醋酸、小苏打都是电解质
D.利用丁达尔效应可以区别NaCl溶液和Fe(OH)3胶体
难度: 中等查看答案及解析
-
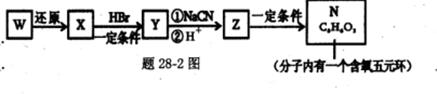
X、Y、Z、W四种物质之间有转化关系如题8图所示(反应条件略),下列有关X、Y的说法错误的是
A.X为H2O,Y为F2
B.x为SiO2,Y为c
C.x为CO2,Y为Mg
D.x为H2O,Y为 C.
难度: 中等查看答案及解析
-
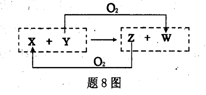
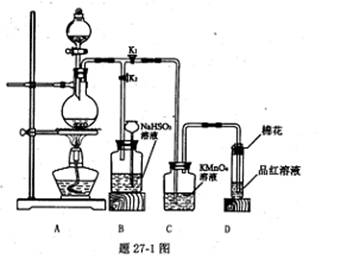
对题9图实验装置的说法正确的是
A.利用①可以制取乙烯 B.装置②可配制一定物质的量浓度的稀硫酸
C.利用③可以进行中和热测定 D.利用④可以进行草酸晶体的分解实验
难度: 中等查看答案及解析
-
常温下,,在下列溶液中一定能大量共存的离子组是
A.在NaC1O的溶液中:I一、SCN-、K+、H+
B.含有大量AlO2一的溶液中:Cl-、Na+、Al3+
C.在c(OH-)=10-12mol/L的溶液中:NH4+、Na+、NO3一
D.在水电离产生的c(OH一)=10-12mol/L的溶液中:NH4+-、K+、HCO3—
难度: 中等查看答案及解析
-
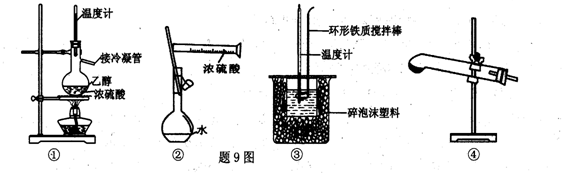
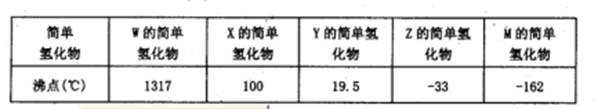
2011年l2月26日媒体报道,在蒙牛纯牛奶中检出强致癌物质黄曲霉素Ml.黄曲霉素AFI'B(题1l图所示)也是污染粮食的真菌霉素.人类的特殊基因在黄曲霉素作用下会发生突变,有引发肝癌的可能性.关于黄曲霉素AFTB的说法正确的是
A.该化合物的分子式为Cl6H11O6
B.该化合物中的所有原子共平面
C.Imol该化合物与NaOH溶液反应,最多可消耗2mol NaOH
D.该化合物易溶于水,能被酸性高锰酸钾氧化
难度: 中等查看答案及解析
-
向绝热恒容密闭容器中只通入A(g)和B(g),在一定条件下使反应A(g)+B(g)
C(g)+D(g);△H=QkJ/mol达到平衡,反应过程中正反应速率随时间变化的示意图如题12图所示.下列说法正确的是
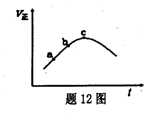
A.在反应体系中加入催化剂,反应速率增大,△H也增大
B.反应物的浓度:a点小于b点
C.反应在c点达到平衡
D.反应达到平衡时,升高温度,A的转化率将减小
难度: 中等查看答案及解析
-
25℃时,将10 mL 0.10 mol/LHA溶液和10 mL 0.10 mol/L HB溶液分别与10 mL 0.10 mol/L NaHCO3溶液混合.实验测得产生的CO2的体积(V)随时间(t)变化的示意图如题13图所示,下列说法正确的是

A.反应结束后,两溶液中c(A一)> c(B—)
B.pH=5.3的NaA与HA的混合溶液中,c(Na+)<c(A一)
C.中和体积相同、pH相同的HA和HB溶液,所消耗NaOH的物质的量后者多
D.在同体积同浓度的NaA和NaB溶液中前者的离子总数比后者多
难度: 中等查看答案及解析

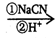 RCOOH.有机化合物A可发生如题28-1图转化关系(无机产物略去),其中G与FeC13溶液能发生显色反应,且环上的一元取代产物只有两种结构.
RCOOH.有机化合物A可发生如题28-1图转化关系(无机产物略去),其中G与FeC13溶液能发生显色反应,且环上的一元取代产物只有两种结构.