-
化学与生产、生活、科技密切相关,下列有关说法错误的是
A. 为保护轮船的外壳,常在外壳上镶入锌块
B. 明矾溶于水后产生具有吸附性的胶体粒子,可作漂白剂
C. 燃料电池的能量转换效率远高于普通燃料燃烧的能量转换效率
D. 锅炉水垢中的硫酸钙可用碳酸钠溶液处理,使之转化为碳酸钙,再用酸除去
难度: 中等查看答案及解析
-
下列关于化学反应的能量变化说法正确的是
A. 任何化学反应都伴随能量变化 B. 氧化还原反应一定是吸热反应
C. 化学反应过程中的能量变化都是热量变化 D. 化学键断裂放出能量,化学键形成吸收能量
难度: 简单查看答案及解析
-
向足量稀硫酸中加入一定量的锌粒,再向其中加入CuSO4溶液,发现生成H2的速率先增大后减小。下列有关说法错误的是
A. 生成H2的速率先增大可能由于溶液温度逐渐升高
B. 生成H2的速率先增大可能由于形成了铜锌原电池
C. 生成H2的速率后减小可能由于锌粒质量减小
D. 生成H2的速率后减小可能是由于置换出的铜太多,覆盖在锌粒表面
难度: 中等查看答案及解析
-
下列事实不能用勒夏特列原理解释的是
A. 实验室中用排饱和食盐水法收集氯气
B. 合成氨工厂生产过程中通常采用较高压强
C. 工业上生产硫酸过程中,通入过量空气以提高SO2利用率
D. 由NO2(g)、N2O4(g)组成的平衡体系加压后最终颜色比加压前深
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数值,下列说法正确的是
A. 1L0.1mo/L的CuCl2溶液中Cu2+数为0.1NA
B. 常温常压下,1.11gCaCl2中含有的Cl-离子数为0.01 NA
C. 铜锌原电池中,锌片质量减少6.5g时,外电路中电子转移0.2NA
D. 向密闭容器中充入1molN2和3mol H2,充分反应时转移电子6NA
难度: 简单查看答案及解析
-
常温下,在下列给定条件的溶液中,一定能大量共存的离子组是
A. c(OH-)=l×10-13mol·L-1的溶液中:K+、Mg2+、Cl-、NO3-
B. 0.1mol/L的NaNO3溶液中:H+、Fe2+、Cl-、SO42-
C. 含有大量Al3+的水溶液中: Na+、NH4+、HCO3-、Br-
D. 水电离产生的c(H+)为1×10-l2mol·L-1的溶液:NH4+、Na+、Cl-、CO32-
难度: 中等查看答案及解析
-
关于常温下pH=3的HF溶液,下列叙述正确的是
A. c(H+)= c(F-)
B. 加水稀释时,c(F-)/c(HF)增大
C. 与pH=11的NaOH溶液等体积混合后,溶液呈碱性
D. 加入NaF固体可以抑制HF的电离,使溶液中c(F-)减小
难度: 中等查看答案及解析
-
将10gCaCO3粉末分别加入到下列溶液中,充分搅拌,各溶液中Ca2+的浓度最小的为
A. 10mL水 B. 10mL,0.01 mol·L-1盐酸溶液
C. 10 mL,0.01mol·L-1Ca(NO3)2溶液 D. 10mL,0.1 mol·L-1K2CO3溶液
难度: 中等查看答案及解析
-
下列叙述正确的是
A. 95℃时纯水的pH<7,说明加热可导致水呈酸性
B. pH=3的醋酸溶液,稀释至10倍时溶液的pH<4
C. 等浓度的醋酸溶液与氢氧化钠溶液等体积混合后pH=7
D. 等体积pH均为3的醋酸和盐酸分别与足量Zn反应,盐酸产生的H2多
难度: 中等查看答案及解析
-
下列装置中铜电极的连接错误的是
A:铜锌原电池
B:电解精炼铜
C:镀件上镀铜
D:电解氯化铜溶液




A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列反应的速率受温度影响不大,主要决定于浓度和扩散速率的是
A. N2(g)+3H2(g)
2NH3(g) ΔH<0 B. 2H2(g)+O2(g)
2H2O(l) ΔH<0
C. H+ (aq)+ OH-(aq)==H2O(l) ΔH<0 D. CaCO3(s)==CaO(s)+ CO2 (g) ΔH >0
难度: 简单查看答案及解析
-
下列反应的离子方程式错误的是
A. H2S通入CuSO4溶液中:H2S+Cu2+==CuS↓+2H+
B. AlCl3溶液与Na2S溶液混合生成沉淀::2 Al3++3S2-==Al2S3↓
C. 用惰性电极电解BaCl2溶液:2Cl-+2H2O
Cl2↑+H2↑+2OH-
D. 用TiCl4制备TiO2的第一步反应:Ti4++ (x+2) H2O(过量)
TiO2·xH2O↓+ 4H+
难度: 简单查看答案及解析
-
已知可逆反应:A(S)+B(g)
C(g)+ D(g) ΔH<0,达到平衡状态时,改变单一条件,下列说法正确的是
A. 绝热环境下加压,体系的温度升高
B. 加入合适的催化剂,B的平衡转化率增大
C. 物质A由块状变为粉末状,正反应速率加快,平衡常数增大
D. 恒温恒容下,当物质A的质量不再改变,则反应达到平衡状态
难度: 中等查看答案及解析
-
下列实验操作能达到目的是
A. 用PH试纸测定次氯酸溶液的pH
B. 将FeCl3溶液加热蒸干并灼烧获得Fe2O3固体
C. 向明矾溶液中加入一定量NaOH,制备Al(OH)3胶体
D. 室温下,测得pH=5的NaHSO4溶液与pH=9的NaHCO3溶液中水的电离程度相等
难度: 中等查看答案及解析
-
反应A→C分两步进行:①A→B,②B→C。反应过程能量变化曲线如图所示(E1、E2、E3、E4表示活化能)。下列说法错误的是

A. 三种物质中B最不稳定 B. A→B反应的活化能为E1
C. B→C反应的ΔH=E4-E3 D. 加入催化剂不能改变反应的焓变
难度: 困难查看答案及解析
-
常温下,下列离子浓度关系正确的是
A. pH=11的氨水中,c(OH-)=c(NH4+)=10-3mol·L-1
B. pH=9的氨水和NH4Cl混合溶液中,c(Cl-)>c(NH4+)
C. 0.1 mol·L-1NH4Cl溶液中,c(H+)=c(NH3·H2O)+c(OH-)
D. 0.1 mol·L-1NH4Cl溶液中,c(Cl-)>c(H+)>c(NH4+)>c(OH-)
难度: 中等查看答案及解析
-
在密闭容器中,对于可逆反应M+3N
2Q(g),平衡时Q的体积分数与温度和压强的关系如图所示,下列判断正确的是
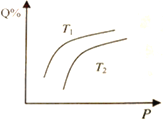
A. M和N不能都为气体
B. 由上图可知, N一定为气体
C. 若正反应方向ΔH>0,则T1<T2
D. 其它条件不变,压强增大,混合气体的平均相对分子质量减小
难度: 中等查看答案及解析
-
微生物电池工作原理如图所示。下列有关说法错误的是

A. 外电路的电流方向是由a到b
B. 正极的电极反应为:O2+4e-+4H+= 2H2O
C. 1mol C6H12O6完全反应生成CO2,转移24mol电子
D. 反应一段时间后,电池内部的氢离子物质的量减少
难度: 中等查看答案及解析
-
下列实验能达到预期目的的是
序号
实验内容
实验目的
A
将FeCl3固体溶于少量浓盐酸中,再加蒸馏水稀释至所需浓度
配制氯化铁溶液
B
常温下,将干电池的温度升高到40℃,其输出电流增大
证明干电池可将环境热能转化为电能
C
向CuCl2溶液中加入NaOH调节pH>4
除去CuCl2的Fe3+杂质
D
向BaSO4悬浊液中加入Na2CO3饱和溶液,过滤出的沉淀加入盐酸有气体生成
证明Ksp(BaCO3)<Ksp(BaSO4)
A. A B. B C. C D. D
难度: 中等查看答案及解析



