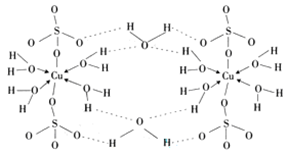
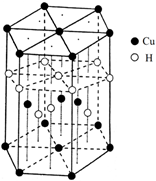
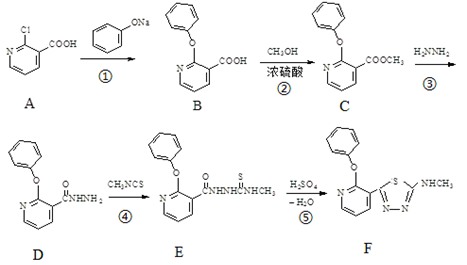
-
化学与资源利用、节能减排、环境保护密切相关。下列措施不利于节能减排、环境保护的是
A.开发利用太阳能、风能等清洁能源 B.将秸秆粉碎后还田以提高肥效
C.大量使用农药、化肥提高农作物产量 D.用脱硫处理的煤代替原煤作燃料
难度: 中等查看答案及解析
-
下列有关化学用语表示不正确的是
A.氯离子的结构示意图:
B.K2O的电子式:
C.CO2分子的结构式:
D.苯分子的比例模型:
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.使紫色石蕊试液变红的溶液:NH4+、Al3+、SO42-、Br-
B.明矾溶液:K+、C1-、S2-、OH-
C.pH=1的溶液:Ag(NH3)2+、Fe3+、ClO4-、NO3-
D.能溶解Al2O3的溶液:Na+、Mg2+、HCO3-、SO42-
难度: 困难查看答案及解析
-
下列有关物质的性质与应用均正确的是
A.常温下Cl2能与强碱溶液反应,工业生产和实验室可用澄清石灰水吸收氯气尾气
B.苯酚遇FeCl3溶液显紫色,可用FeCl3溶液检验工业生产的废水中是否存在苯酚
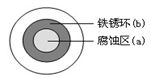
C.铜的金属活动性比铁的弱,可在海轮外壳上装若干铜块以减缓船体的腐蚀速率
D.碳酸钠溶液与硫酸钙能发生复分解反应,可用硫酸钠溶液清除锅炉水垢中的碳酸钙
难度: 中等查看答案及解析
-
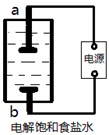
用下列实验装置进行相应实验,不能达到实验目的的是
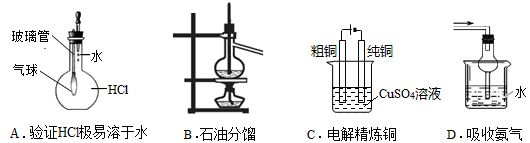
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值。下列叙述不正确的是
A.1 mol Na2O和Na2O2的混合物中含有的阴、阳离子总数是3NA
B.常温下,1 L 0.1 mol·L-1的NH4NO3溶液中含有的氮原子数为0.2NA
C.46 g有机物C2H6O中含有的H—O键的数目为NA
D.标准状况下,将0.1 mol Cl2通入足量NaOH溶液中,反应转移的电子数为0.1NA
难度: 中等查看答案及解析
-
下列物质的转化在给定条件下不能实现的是
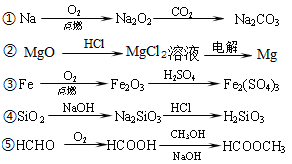
A.①②③ B.②③④ C.②③⑤ D.①④⑤
难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
A.澄清石灰水中滴加少量的小苏打溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O
B.醋酸溶液和大理石中的CaCO3反应:CaCO3+2H+=Ca2++H2O+CO2↑
C.NH4Al (SO4)2溶液中滴加少量的NaOH溶液:NH4++OH-=NH3·H2O
D.用氢氧化钠溶液除去铝表面的氧化膜:Al(OH)3+OH-=AlO2-+2H2O
难度: 困难查看答案及解析
-
下列有关说法错误的是
A.反应NH3(g)+HCl(g)=NH4Cl(s)低温下能自发进行,说明该反应的△H<0
B.Mg在空气中燃烧时发出耀眼的白光,可用于制造信号弹
C.纯碱溶于热水中去污效果增强,说明纯碱的水解是吸热反应
D.反应N2(g)+3H2(g)=2NH3(g)(△H<0)达平衡后,降低温度,正反应速率增大、逆反应速率减小,平衡向正反应方向移动
难度: 中等查看答案及解析
-
下列四个图像的有关说法正确的是
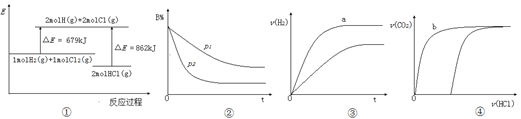
A.①表示反应H2(g)+Cl2(g)=2HCl(g)的能量变化,则该反应的△H=183 kJ·mol-1
B.②表示其它条件不变时,反应4A(g)+3B(g)
2C(g)+6D在不同压强下B%(B的体积分数)随时间的变化,则D一定是气体
C.③表示体积和pH均相同的HCl、CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示的是HCl溶液
D.④表示10 mL 0.1 mol·L-1 Na2CO3和NaHCO3两种溶液中,分别滴加0.l mol/L HCl溶液时,CO2的体积随盐酸体积的变化,则b表示的是NaHCO3溶液
难度: 困难查看答案及解析
-
2013年4月5日,国家食品药品监督管理总局批准了抗H7N9流感新药帕拉米韦氯化钠注射液,其结构如图所示。下列关于帕拉米韦的说法正确的是
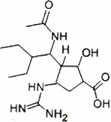
A.帕拉米韦的分子式为C15H28N4O4
B.1 mol帕拉米韦最多可以与3 mol NaOH发生反应
C.帕拉米韦能发生取代、加成、消去和氧化反应
D.帕拉米韦为水溶性药物,其分子中有6个手性碳原子
难度: 困难查看答案及解析
-
X、Y、Z、W是原子序数依次增大的短周期主族元素,X与Z同主族,X原子的最外层电子数是其最内层电子数的2倍,Y原子的最外层电子数比W原子的少2个。下列叙述一定正确的是
A.X、Y的单质均可以导电
B.原子半径:Z>W
C.X、Z的氧化物均为酸性氧化物
D.Y、W的最高价氧化物的水化物均易溶于水
难度: 中等查看答案及解析
-
下列根据实验操作和现象所得出的结论正确的是
选项 实验操作 实验现象 结论
A 向1 mL 1% NaOH溶液加入2 mL 2%的CuSO4溶液,振荡后滴加0.5 mL葡萄糖溶液,加热 未出现红色沉淀 葡萄糖中不含有醛基
B 向溶液X中先滴加盐酸,再滴加BaCl2溶液 滴加盐酸时无明显现象,滴加BaCl2溶液时出现白色沉淀 X中一定含有SO42-
C AgCl饱和溶液中加入少量NaI溶液 产生黄色沉淀 Ksp(AgI)>Ksp(AgCl)
D 向加入了几滴酚酞试液的Na2CO3溶液中滴加BaCl2溶液 红色逐渐褪去 Na2CO3溶液中存在水解平衡
难度: 困难查看答案及解析
-
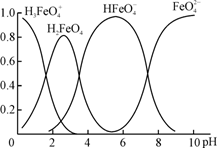
常温下,下列有关溶液中微粒的物质的量浓度关系正确的是
A.pH均为9的①Na2CO3溶液、②CH3COONa溶液、③NaOH溶液,其物质的量浓度的大小顺序为:①>②>③
B.向饱和氯水中加入NaOH溶液至pH=7,所得溶液中:c(Na+)>c(ClO-)>c(Cl-)>c(OH-)
C.0.1 mol·L-1 KHC2O4溶液中:c(OH-)=c(H+) +c(H2C2O4)-2c(C2O42-)
D.等物质的量浓度Na2CO3溶液和NaHCO3溶液等体积混合,所得溶液中:c(CO32-)+c(OH-)< c(H+)+c(HCO3-)+3c(H2CO3)
难度: 极难查看答案及解析
-
物质(t-BuNO)2在正庚烷或CCl4中均可以发生反应:(t-BuNO)2
2(t-BuNO)。在20℃时,向1 L正庚烷中加入(t-BuNO)2 0.50 mol,10 min时反应达平衡,此时(t-BuNO)2的平衡转化率为65%(假设反应过程中溶液体积始终为1 L)。下列说法正确的是
A.反应在前10 min内的平均速率为ν(t-BuNO)=0.0325 mol·L-1·min-1
B.保持其他条件不变,若此时再向溶液中加入0.50 mol (t-BuNO)2,重新达平衡时(t-BuNO)2的百分含量减小
C.保持其他条件不变,若该反应在CCl4中进行,其平衡常数为1.9,则(t-BuNO)2的平衡转化率小于65%
D.保持其他条件不变,升高温度, (t-BuNO)2的平衡转化率大于65%,则其能量关系可用下图表示
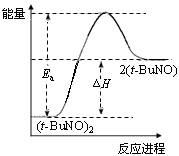
难度: 困难查看答案及解析