-
下列说法正确的是( )
A. H2O2具有强氧化性可用于杀菌消毒
B. 热的碳酸钠溶液去油污能力强,蒸干碳酸钠溶液得到NaOH固体
C. 向鸡蛋清的溶液中加入浓的硫酸钠溶液或福尔马林,蛋白质的性质发生改变并凝聚
D. 油脂在酸性条件下易水解,可用于制作肥皂
难度: 简单查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A. 标况下,将5.6g铁片投入足量浓硝酸中生成6.72L NO2气体
B. lmolFeBr2与1.2mol Cl2反应转移的电子数为2.4mol
C. 1L 1mol·L-1的草酸溶液中含有的H+数为2NA
D. 标准状况下,2.24L乙醇中碳氢键的数目为0.5NA
难度: 中等查看答案及解析
-
化合物
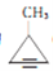 (b)、
(b)、 (d)、CH≡C—CH=CH2(p)的分子式均为C4H4。下列说法正确的( )
(d)、CH≡C—CH=CH2(p)的分子式均为C4H4。下列说法正确的( )A. b的一氯代物只有两种 B. d的同分异构体只有b、p两种
C. b.d.p均可与溴水发生加成反应 D. p的所有原子不可能处于同一平面
难度: 简单查看答案及解析
-
下列根据实验现象得H 的实验结论正确的是
选项
实验操作
实验现象
实验结论
A
将Fe(N03)2样品溶于稀硫酸后,滴加KSCN溶液
溶液变成红色
Fe(NO3)2样品中一定含有Fe3+
B
向KI溶液中加入少量苯,然后加入FcCl3溶液
有机层呈橙红色
还原性 Fe3+>I-
C
向浓度均为0.1mol/L的Na2CO3和Na2S混合溶液滴入少量AgNO3溶液
产生黑色沉淀(Ag2S)
Ksp(Ag2S)>Ksp(Ag2CO3)
D
向某溶液中加入KOH溶液并加热,管口放湿润的红色石蕊试纸
试纸变为蓝色
原溶液片含有NH4+
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是其电子层数的 2倍,X、Y的核电荷数之比为3:4,W的最外层为7电子结构。金属单质Z在空气中燃烧生成的化合物可与水发生氧化还原反应。下列说法正确的是( )
A. X与Y能形成多种化合物,一般条件下都能与Z的最高价氧化物的水化物发生反应
B. 原子半径大小:X<Y,Z>W
C. 化合物Z2Y和ZWY3都只存在离子键
D. Y、W的某些单质或两元素之间形成的某些化合物可作水的消毒剂
难度: 中等查看答案及解析
-
用铁和石墨作电极电解酸性废水,可将废水中的PO43-以FePO4(不溶于水)的形式除去,其装置如图所示。
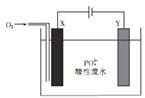
下列说法正确的是
A. 若X、Y电极材料连接反了,则仍可将废水中的PO43- 除去
B. X极为石墨,该电极上发生氧化反应
C. 电解过程中Y极周围溶液的pH减小
D. 电解时废水中会发生反应:4Fe2++02-4H++4P043-=4FePO4↓+2H2O
难度: 中等查看答案及解析
-
下图所示与对应叙述不相符的是( )
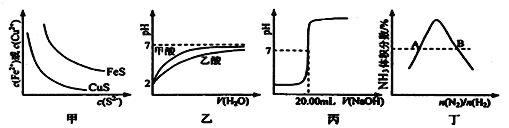
A. 图甲表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则Ksp(FeS) >Ksp(CuS)
B. 图乙表示pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸>乙酸
C. 图丙用0.1000 mol·L-lNaOH溶液滴定25.00 mL盐酸的滴定曲线,则 c(HCl)=0.0800 mol ·L-1
D. 图丁表示反应N2(g)+3H2(g)
2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
难度: 困难查看答案及解析
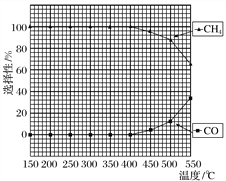
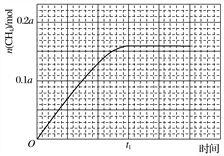
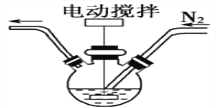
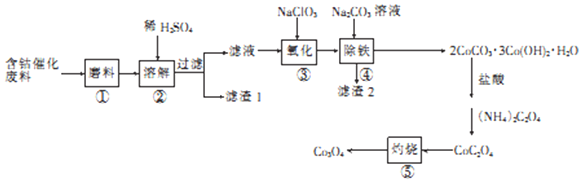
 的合成路线流程图____(无机试剂可任选)。合成路线流程图示例如图:
的合成路线流程图____(无机试剂可任选)。合成路线流程图示例如图: 。
。