-
下列说法中,不正确的是
A.光导纤维的主要成分是SiO2
D.玻璃和陶瓷都属于传统硅酸盐材料
C.明矾和漂白粉均可用于自来水的杀菌、消毒
D.大量排放SO2会引起酸雨
难度: 简单查看答案及解析
-
反应产物除与反应物的结构、性质有关,还与反应的条件有关。下列各组物质反应时:
①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Na与O2中,由于浓度或条件不同得到不同产物的是:
A.①② B.①③ C.②③ D.①②③
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是
A.质子数为53、中子数为78的碘原子:
B.N2的电子式:
C.S2—的结构示意图:
D.邻羟基苯甲酸的结构简式:
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是
A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+
B.水电离出的c(H+)=10-12mol/L的溶液中:Ca2+、K+、Cl-、HCO3-
C.c(H+)/c(OH-)=1012的水溶液中:NH4+、Al3+、NO3-、Cl-
D.c(Fe3+)=0.1mol/L的溶液中:K+、ClO-、SO42-、SCN-
难度: 简单查看答案及解析
-
下列因果关系叙述正确的是
A.SO2具有漂白性,故可使酸性KMnO4溶液褪色
B.浓硝酸中的HNO3见光会分解,故有时在实验室看到的浓硝酸呈黄色
C.Na的金属性比Mg强,故可用Na与MgCl2溶液反应制取Mg
D.Fe在Cl2中燃烧生成FeCl3,故在与其他非金属反应的产物中Fe也显+3价
难度: 简单查看答案及解析
-
下列物质转化在给定条件下能实现的是
①
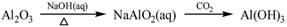
②
③
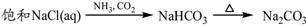
④
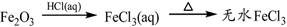
A.①③ B.②③ C.②④ D.①④
难度: 简单查看答案及解析
-
工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
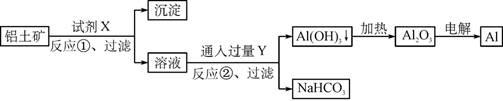
下列叙述正确的是
A.试剂X可以是氢氧化钠溶液,也可以是盐酸
B.反应①过滤后所得沉淀为氢氧化铁
C.图中所示转化反应都不是氧化还原反应
D.反应②的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
难度: 简单查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
A.FeCl3溶液与Cu的反应:Cu + Fe3+ = Cu2+ + Fe2+
B.NO2与水的反应:3NO2 + H2O = 2NO3- + NO + 2H+
C.醋酸溶液与水垢中的CaCO3反应:CaCO3 + 2H+ = Ca2+ + H2O + CO2↑
D.向NaAlO2溶液中通入过量CO2:2AlO2- + CO2 + 3H2O = 2Al(OH)3↓+ CO32-
难度: 简单查看答案及解析
-
下列说法正确的是
①Cl2的化学性质活泼,它与H2混合后立即发生爆炸;
②实验室制取Cl2时,为了防止环境污染,多余的氯气可以用澄清石灰水吸收;
③新制氯水的氧化性强于久置氯水;
④检验HCl气体中是否混有Cl2的方法是将气体通入AgNO3溶液;
⑤除去HCl气体中的Cl2,可将气体通入饱和食盐水。
A.③ B.③⑤ C.①②③ D.②③④
难度: 简单查看答案及解析
-
R2O8n-离子在一定条件下可把Mn2+氧化成
,若反应后
变成
,且反应中氧化剂与还原剂的离子个数比为5:2,则R2O8n-中R元素的化合价以及n分别为
A.+7,2 B.+6,2 C.+5,1 D.+4,1
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列叙述正确的是
A.一定温度下,15g甲醛和乙酸的混合物中O原子数为0.5NA
B.标准状况下,NO和O2各11.2L混合,所得混合气体的分子总数为0.75NA
C.14g分子通式为CnH2n的链烃中含有的C=C的数目为NA /n
D.在反应KIO3 + 6HI = KI + 3I2 + 3H2O中,每生成3mol I2转移的电子数为6NA
难度: 简单查看答案及解析
-
锑(Sb)在自然界一般以硫化物的形式存在,我国锑的蕴藏量为世界第一。从硫化物中提取单质锑一般是先在高温下将硫化物转化为氧化物,再用碳还原:
①2Sb2S3 + 3O2 + 6Fe
Sb4O6 + 6FeS ②Sb4O6 + 6C
4Sb + 6CO↑
关于反应①、②的说法正确的是
A.反应①②中的氧化剂分别是Sb2S3、Sb4O6
B.反应①中每生成3 mol FeS时,共转移6 mol电子
C.反应②说明高温下C的还原性比Sb强
D.每生成4mol Sb时,反应①与反应②中还原剂的物质的量之比为4∶3
难度: 简单查看答案及解析
-
NaCl是一种化工原料,可以制备一系列物质(见图)。下列说法正确的是
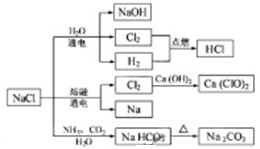
A.25℃,NaHCO3在水中的溶解度比Na2CO3的大
B.图中所示转化反应都是氧化还原反应
C.常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应
D.石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂
难度: 简单查看答案及解析
-
将一定量铁粉和铜粉的混合物加入由稀H2SO4和稀HNO3组成的混合溶液中,充分反应后金属粉末有剩余,下列有关推断正确的是
A.反应过程中不可能产生H2
B.剩余的金属粉末中一定有铜
C.往反应后的溶液中加入KSCN溶液会变血红色
D.往反应后的溶液中加入足量的稀H2SO4,则金属粉末的质量一定会减少
难度: 简单查看答案及解析
-
2.8gFe全部溶于一定浓度、200mL的HNO3溶液中,得到标准状况下的气体1.12L,测得反应后溶液的pH为1。若反应前后溶液体积变化忽略不计,则下列有关判断正确的是
A.反应后溶液中铁元素一定只以Fe3+ 形式存在
B.1.12L气体可能是NO、NO2的混合气体
C.反应后溶液中c(NO3-)=0.85mol/L
D.反应后的溶液最多还能溶解1.4gFe
难度: 简单查看答案及解析

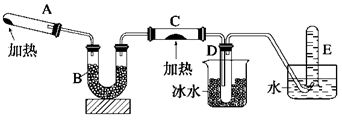
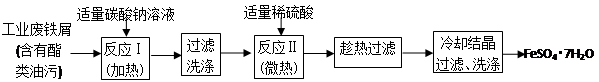
 (4)、步骤Ⅲ需要100mL1mol/L的稀硫酸,用98.3%,ρ=1.84g/cm3的浓硫酸配制,所用的仪器有量筒、烧杯、玻璃棒、胶头滴管及________。写出步骤Ⅳ的离子方程式:________。
(4)、步骤Ⅲ需要100mL1mol/L的稀硫酸,用98.3%,ρ=1.84g/cm3的浓硫酸配制,所用的仪器有量筒、烧杯、玻璃棒、胶头滴管及________。写出步骤Ⅳ的离子方程式:________。