-
空气中,体积分数约为78%的是
A.氧气 B.氮气 C.二氧化碳 D.水蒸气
难度: 简单查看答案及解析
-
地壳中含量最多的元素是
A.氧 B.硅 C.铝 D.铁
难度: 简单查看答案及解析
-
下列物质中,属于单质的是
A.二氧化碳 B.氧气 C.空气 D.烧碱
难度: 简单查看答案及解析
-
下列物质在氧气中燃烧,发出蓝紫色火焰的是
A.硫粉 B.木炭 C.铁丝 D.红磷
难度: 简单查看答案及解析
-
下列生活用品所使用的主要材料,属于有机合成材料的是




A.纯棉毛巾 B.纯羊毛衫 C.合成橡胶轮胎 D.真丝围巾
难度: 简单查看答案及解析
-
氧元素与氮元素的本质区别是
A.电子数不同 B.质子数不同 C.中子数不同 D.最外层电子数不同
难度: 简单查看答案及解析
-
下列物质放入水中,能形成溶液的是
A.蔗糖 B.泥沙 C.植物油 D.牛奶
难度: 简单查看答案及解析
-
氢氧化钙可用作建筑材料,其俗称是
A.熟石灰 B.生石灰 C.烧碱 D.石灰石
难度: 简单查看答案及解析
-
下列物质中,表示2个氢分子的是
A. H2 B.2H2 C.2H D.2H+
难度: 简单查看答案及解析
-
加碘盐中的“碘”指的是
A.元素 B.原子 C.分子 D.单质
难度: 简单查看答案及解析
-
下列化学方程式中,书写正确的是
A.2H2O2
2H2O + O2↑ B.4Fe + 3O2
2Fe2O3
C.H2 + O2
H2O D.2Ag + 2HCl ="=" 2AgCl + H2↑
难度: 简单查看答案及解析
-
下列实验基本操作中,正确的是

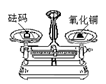

A.加热液体 B.称量氧化铜 C.取用固体粉末 D.过滤
难度: 简单查看答案及解析
-
下列物质性质的表述中,属于化学性质的是
A.氢氧化钠易潮解 B.浓盐酸易挥发
C.金属具有延展性 D.碳酸易分解
难度: 简单查看答案及解析
-
下列措施不正确的是
A.眼睛里溅进了药液,要立即用水冲洗
B.加热时,试管口不要对着自己或他人
C.洒出的酒精在实验台上燃烧起来,要用湿抹布盖灭
D.氢氧化钠沾到皮肤上,要用大量的水冲洗,再涂上硫酸
难度: 简单查看答案及解析
-
下列反应中,属于置换反应的是
A.2H2O
2H2↑+ O2↑
B.2NaOH + CuSO4 ="==" Cu(OH)2↓+ Na2SO4
C.2CuO + C
2Cu + CO2↑
D.CaO + 2HCl ="=" CaCl2 + H2O
难度: 简单查看答案及解析
-
下列现象中,能说明某溶液呈酸性的是
A.用pH试纸测定,其pH=8
B.用pH试纸测定,其pH=7
C.向其中滴加紫色石蕊溶液,呈红色
D.向其中滴加无色酚酞溶液,呈红色
难度: 简单查看答案及解析
-
下列关于水的说法中,不正确的是
A.爱护水资源要节约用水、防治水体污染
B.水中某些杂质可用活性炭吸附除去
C.电解水实验可以说明水由氢气和氧气组成
D.每个水分子由2个氢原子和1个氧原子构成
难度: 简单查看答案及解析
-
下列说法中,不正确的是
A.雾霾与空气污染有关
B.废旧电池应埋入地下
C.化石燃料的燃烧会造成空气污染
D.汽车改用压缩天然气,可以减少汽车尾气的污染
难度: 简单查看答案及解析
-
下列关于水变成水蒸气的说法中,正确的是
A.水的沸点发生了变化 B.水的化学性质发生了变化
C.水分子的大小发生了变化 D.水分子间的距离发生了变化
难度: 简单查看答案及解析
-
下列物质的鉴别方法不正确的是
A.用燃着的木条鉴别氧气和二氧化碳 B.用水鉴别食盐和碳酸钙粉末
C.用稀盐酸鉴别铜和金 D.用铜片鉴别硝酸银溶液和硫酸锌溶液
难度: 简单查看答案及解析
-
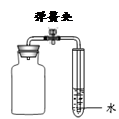
下列关于测定空气中氧气的含量实验(图中药品为红磷和水)的分析中,不正确的是

A.氮气不与红磷反应且难溶于水,是设计该实验的依据之一
B.不能用木炭代替红磷
C.图I中进入广口瓶的水约占烧杯中水的五分之一
D.图II所示装置也可以测定空气中氧气含量
难度: 简单查看答案及解析
-
下列实验中,实验方案与结论的对应关系正确的是
实验方案 结论
A 向盛装CO2的塑料瓶中加入NaOH溶液,观察到瓶身变瘪 说明CO2能与NaOH反应
B 木炭在空气和氧气中均能燃烧 说明氮气能支持燃烧
C 某红色粉末发生分解反应,只生成单质汞和氧气 该粉末由氧元素和汞元素组成
D 向紫色石蕊溶液中通入CO2,石蕊溶液变红 CO2属于酸
难度: 简单查看答案及解析
-
体操运动员常用一种白色的“镁粉”搓手,去除手上的汗渍,增加掌心与器械的摩擦力。这种“镁粉”溶解性很差,但有很好的吸水性。向“镁粉”中加入适量稀盐酸,立刻产生大量气泡,产生的气体能使澄清石灰水变浑浊,同时得到无色澄清溶液;将“镁粉”加入适量水长时间煮沸后,滤出白色固体,加入稀盐酸,固体溶解,但不产生气泡。下列说法正确的是
A.该“镁粉”是单质镁
B.可以用生石灰替代“镁粉”除去汗渍
C.“镁粉”加水煮沸后滤出的白色固体是碳酸镁
D.“镁粉”加水煮沸的过程中一定发生了化学变化
难度: 简单查看答案及解析
-
根据下图所示的实验过程和提供的数据,下列判断不正确的是

A.I中未变质的NaOH质量为5.3 g B.II中溶液有两种溶质
C.III中溶液溶质的质量分数为8% D.IV中溶液为红色
难度: 中等查看答案及解析