-
以色列科学家发现准晶体独享2011年诺贝尔化学奖。已知的准晶体都是金属互化物。有关准晶体的组成与结构的规律仍在研究之中。人们发现组成为铝-铜-铁-铬的准晶体具有低摩擦系数、高硬度、低表面能以及低传热性,正被开发为炒菜锅的镀层;Al65Cu23Fe12十分耐磨,被开发为高温电弧喷嘴的镀层。下列说法正确的是( )
A.离子化合物形成的晶体一定有金属元素
B.共价化合物中一定没有非极性键
C.合金是纯净物
D.准晶体可开发成为新型材料
难度: 中等查看答案及解析
-
下列表述正确的是( )
A.16O与18O互为同位素;H216O与H218O互为同素异形体 B.N2的结构式为:N三N
C.S2-的结构示意图:
D.次氯酸分子的电子式为
难度: 中等查看答案及解析
-
浓硫酸有许多重要的性质,在与含有水分的蔗糖作用过程中不能显示的性质是( )
A.酸性 B.脱水性 C.强氧化性 D.吸水性
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数,下列说法正确的是( )
A.常温常压下,1.6 g O 2和O 3混合气体中原子总数为0. 1NA
B.标况下,过氧化钠与水 反应生成1.12L氧气时转移电子数目为0.2NA
C.0.1 mol·L -1的CH 3COONa溶液中CH 3COOH和CH 3COO -的总数为0.1NA
D.常温常压下,4 g He中,含有的原子数为2 NA
难度: 中等查看答案及解析
-
下列各组物质,用一种试剂无法区别的是( )
A.四种无色溶液:NaCl、NaOH、KOH、KCl
B.四种黑色粉末:FeO、Fe、CuO、C
C.三种浓酸:HNO3、H2SO4、HCl
D.四种白色粉末:(NH4)2SO4、NH4Cl、Na2SO4、NaCl
难度: 中等查看答案及解析
-
下列溶液中通入SO2一定不会产生沉淀的是( )
A.Ba(OH)2 B.Ba(NO3)2 C.Na2S D.BaCl2
难度: 中等查看答案及解析
-
下列情况下,可以大量共存的离子组是( )
A.使pH试纸呈红色的溶液中:Fe2+、NO3-、SO42-、Na+
B.由水电离的c(H+) = 1×10-14 mol·L-1的溶液中:Ba2+、K+、Cl-、HCO3-
C.与铝反应放出大量氢气的溶液中:NH4+、SO42-、CO32-、Na+
D.在c(H+)/ c(OH-)=1012的溶液中:NH4+ 、Al3+、Ca2+、Cl-
难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.碳酸钙与醋酸溶液反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑
B.碳酸氢镁溶液中加入足量的烧碱溶液:Mg2+ + 2HCO3- + 2OH- = MgCO3↓+ CO32-+ 2H2O
C.Fe(NO3)3的酸性溶液中通入足量硫化氢:2Fe3++H2S=2Fe2++S↓+2H+
D.H218O中投入Na2O2:2H218O+2Na2O2=4Na++4OH-+18O2↑
难度: 中等查看答案及解析
-
高铁酸钾( K2FeO4)是一种新型的自来水处理剂,它的性质和作用是( )
A.有强氧化性,可消毒杀菌,还原产物能吸附水中杂质
B.有强还原性,可消毒杀菌,氧化产物能吸附水中杂质
C.有强氧化性,能吸附水中杂质,还原产物能消毒杀菌
D.有强还原性,能吸附水中杂质,氧化产物能消毒杀菌
难度: 中等查看答案及解析
-
下列溶液中,不能区别SO2和CO2气体的是( )
①石灰水 ②H2S溶液 ③KMnO4溶液 ④溴水 ⑤酸化的Ba(NO3)2溶液 ⑥品红溶液
A.①②③⑤ B.②③④⑤ C.① D.①③
难度: 中等查看答案及解析
-
下列有关物质的性质和该性质的应用均正确的是( )
A.常温下浓硫酸能使铝发生钝化,可在常温下用铝制贮藏罐贮运浓硫酸
B.二氧化硅不与任何酸反应,可用石英制造耐酸容器
C.二氧化氯具有还原性,可用于自来水的杀菌消毒
D.铜的金属活泼性比铁的差,可在海轮外壳上装若干铜块以减缓其腐蚀
难度: 中等查看答案及解析
-
将某些化学知识用数轴表示,可以收到直观、简明、易于记忆理解的效果。用数轴表示的下列知识正确的是( )

难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.Fe分别与氯气和稀盐酸反应所得氯化物相同
B.K、Al分别与不足量的稀硫酸反应所得溶液均呈中性
C.Li、Na、K的原子半价和密度随原子序数的增加而增大
D.C、P、S、Cl的最高价氧化物对应水化物的酸性逐渐增强
难度: 中等查看答案及解析
-
某溶液中可能含有Na+、NH4+、Ba2+、SO42-、I-、S2-。分别取样:①用pH计测试,溶液显弱酸性;②加氯水和淀粉无明显现象。为确定该溶液的组成,还需检验的离子是( )
A. Na+ B.SO42- C. Ba2+ D.NH4+
难度: 中等查看答案及解析
-
将0.4gNaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
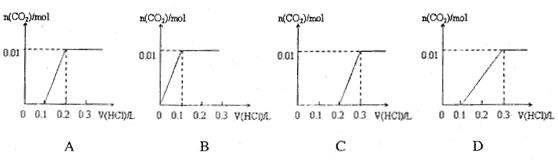
难度: 中等查看答案及解析
-
把一定量的锌与100mL 18.5mol/L的浓硫酸充分反应后,锌完全溶解,同时生成气体Y 33.6L(在标准状况下)。将反应后的溶液稀释到1L,测得溶液的pH=1,则下列叙述正确的是( )
A.气体Y是SO2 B.气体Y中SO2和H2的体积比为4:1
C.反应中共消耗锌87.5g D.反应中共转移电子3mol
难度: 中等查看答案及解析




