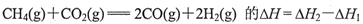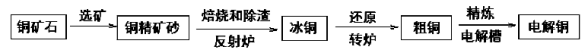-
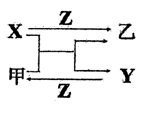
碱式碳酸钴[ Cox(OH)y(CO3)z ]常用作电子材料,磁性材料的添加剂,受热时可分解生成三种氧化物。为了确定其组成,某化学兴趣小组同学设计了如图所示装置进行实验。
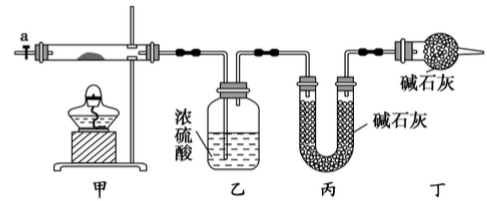
(1)请完成下列实验步骤:
①称取3.65g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,并检验装置气密性;
③加热甲中玻璃管,当乙装置中____________(填实验现象),停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算。
(2)步骤④中缓缓通入空气数分钟的目的是_____________________
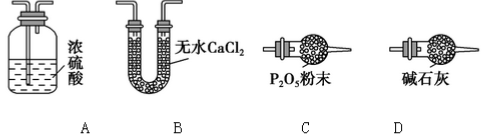
(3)某同学认为上述实验装置中存在一个明显缺陷,为解决这一问题,可选用下列装置中的______(填字母)连接在_________(填装置连接位置)。
(4)若按正确装置进行实验,测得如下数据:
| 乙装置的质量/g | 丙装置的质量/g |
| 加热前 | 80.00 | 62.00 |
| 加热后 | 80.36 | 62.88 |
则该碱式碳酸钴的化学式为_________________。
(5)含有Co(AlO2)2的玻璃常用作实验室观察钾元素的焰色反应,该玻璃的颜色为___________。
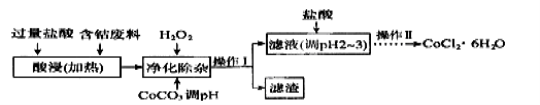
(6)CoCl2·6H2O常用作多彩水泥的添加剂,以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种工艺如下:
已知:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | CO(OH)2 | Al(OH)2 |
| 开始沉淀(PH) | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀(PH) | 4.1 | 9.7 | 9.2 | 5.2 |
①净除杂质时,加入H2O2 发生反应的离子方程式为______________。
②加入CoCO3调PH为5.2~7.6,则操作Ⅰ获得的滤渣成分为_____________。
③加盐酸调整PH为2~3的目的为__________________________________。
④操作Ⅱ过程为___________(填操作名称)、过滤。
-
CuCl2、CuCl是重要的化工原料,广泛地用作有机合成催化剂。实验室中以粗铜(含杂质Fe)为原料,一种制备铜的氯化物的流程如下:
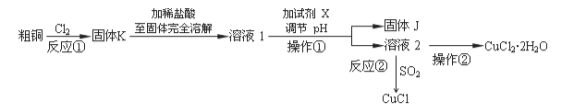
请回答下列问题:
(1)如图装置进行反应①,导管a通入氯气
(夹持仪器和加热装置省略)。观察到的现象是 ,
写出铜与氯气反应的化学方程式 。
(2)上述流程中固体K溶于稀盐酸的目的是 。
试剂X、固体J的物质最好分别为 。
a.NaOH Fe(OH)3 b.NH3·H2O Fe(OH)2
c.CuO Fe(OH)3 d.CuSO4 Cu(OH)2
(3)反应②是向溶液2中通入一定量的SO2,加热一段时间后生成CuCl白色沉淀。写出制备CuCl的离子方程式 。
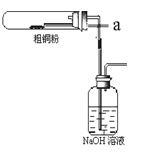
(4)反应后,如图盛有NaOH溶液的广口瓶中溶液具有漂白、消毒作用,若用钢铁(含Fe、C)制品盛装该溶液会发生电化学腐蚀,钢铁制品表面生成红褐色沉淀,溶液会失去漂白、杀菌消毒功效。该红褐色沉淀的主要化学式是 。该腐蚀过程的正极反应式为 。
(5)以石墨为电极,电解CuCl2溶液时发现阴极上也会有部分CuCl析出,写出此过程中阴极上的电极反应式 。
-
《华北电力大学学报:社会科学版》2014年第2期的文章《欧盟暂停征收航空碳排放税的法律思考》,该文章从欧盟暂停征收航空碳排放税的背景人手,分析了欧盟征收航空碳排放税的争议焦点所在,最后对欧盟暂停征收航空碳排放税进行了评析,并提出征收航空碳排放税是未来趋势的观点,希望在反对声中换一个视角来阐述征收航空碳排放税对于环境保护、技术革新和国际法的促进作用。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
____C+____KMnO4+____H2SO4→____CO2↑+____MnSO4+____K2SO4+____H2O
(2)在2 L密闭容器中加入NO和活性炭(无杂质),生成气体E和F。当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
|   物质 物质
T/℃ n/mol | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2。
①计算:K1=__________________。
②根据上述信息判断,温度T1和T2的关系是(填序号) 。
A. T1大于T2 B. T1小于T2 C.无法比较
(3)工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g)  CO2(g)+H2(g) △H=-41 kJ/mol
CO2(g)+H2(g) △H=-41 kJ/mol
已知:2H2O (g) == 2H2 (g) + O2 (g) ΔH=+484 kJ/mol,
①写出CO完全燃烧生成CO2的热化学方程式: 。
②某温度下,在一容积可变的容器中, CO转化生成CO2的反应达到平衡时, CO、O2和CO2的物质的量分别为4 mol、2 mol、和4 mol.保持温度和压强不变,对平衡混合物中三者的物质的量作如下调整,可使平衡右移的是:____________________。
A. 均增加1 mol B. 均加倍 C. 均减少1 mol D. 均减半
(4)草酸二甲酯水解产物草酸(H2C2O4)为二元中强酸
① 草酸氢钾溶液中存在如下平衡:
H2O H++OH-、HC2O4-
H++OH-、HC2O4- H++C2O42-和 。
H++C2O42-和 。
② 向0.1 mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是 _____________________(填序号)。
a.c(K+) = c(HC2O4-) + c(H2C2O4) + c(C2O42-)
b.c(K+) + c(Na+) = c(HC2O4-) + c(C2O42-)
c.c(Na+) = c(H2C2O4) + c(C2O42-)
d.c(K+) > c(Na+)
-
【化学——选修2:化学与技术】
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下:
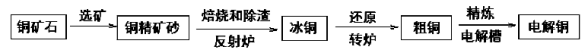
(1)在反射炉中,把铜精矿砂和石英砂混合加热到10000C左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转变为低价氧化物,该过程中两个主要反应的化学方程式分别是 , 反射炉内生成炉渣的主要成分是 ;
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%。转炉中,将冰铜加熔剂(石英砂)在1200°C左右吹入空气进行吹炼。冰铜中的Cu2S被氧化成Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式分别是 ; ;
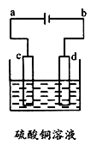
(3)粗铜的电解精炼如图所示。在粗铜的电解过程中,粗铜板应是图中电极 (填图中的字母);在电极d上发生的电极反应式为 ;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为 。
-
【化学——选修3:物质结构与性质】
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于元素周期表的________区;溴的价电子排布式为________________。
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是____________。
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是_________(写出名称)。
| 氟 | 氯 | 溴 | 碘 |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
(4)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图I、II所示:
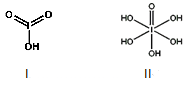
请比较二者酸性强弱:HIO3_____ H5IO6(填“>”、 “<”或“=”)。
(5)硼酸(H3BO3)是一种片层状结构的白色晶体,层内的H3B03分子间通过氢键相连(如下图)。则1 molH3BO3的晶体中有 mol氢键。
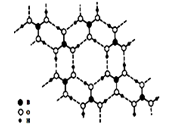
硼酸溶于水生成弱电解质一水合硼酸B(OH)3·H2 O,它电离生成少量[B(OH)4] 一和H+,则 [B(OH)4]一含有的化学键类型为 。
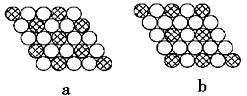
(6)如图所示的二维平面晶体示意图中表示化学式为AX3的是________。
-
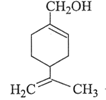
【化学—选修5有机化学基础】
物质A(C5H8)是形成天然橡胶的单体,它的一系列反应如下图所示(部分反应条件略去):

请按要求回答下列问题:
(1)反应①和③的反应类型分别是_____________、_____________。
(2)B的分子式为_________________;B形成高聚物的结构简式为_______________________。
(3)反应②的化学方程式为________________________。
(4)C为一溴代物,分子中含 均2个,反应④的化学方程式为_____________________。
均2个,反应④的化学方程式为_____________________。
(5)A的名称是______________________。
写出所有符合下列条件的A的同分异构体的结构简式:____________________
①环状 ②核磁共振氢谱显示有2种氢原子 ③不含立体异构________________________。
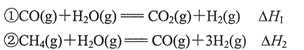
,则H2的燃烧热为