-
下列关于能源和作为能源的物质叙述错误的是( )
A.化石能源物质内部蕴涵着大量的能量
B.绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来
C.物质的化学能可以在不同的条件下转化为热能、电能被人类利用
D.吸热反应没有利用价值
难度: 中等查看答案及解析
-
为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想。下列说法正确的是( )
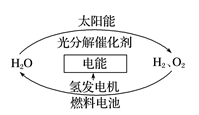
A.H2O的分解反应是放热反应
B.氢能源已被普遍使用
C.2 mol 液态H2O具有的总能量低于2 mol H2和1 mol O2的能量
D.氢气不易贮存和运输,无开发利用价值
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定
B.500℃、30M Pa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)
2NH3(g) ΔH = -38.6 kJ/mol
C.已知热化学方程式:2SO2(g)+O2(g)
2SO3(g) ΔH = -Q kJ/mol ,若将一定量的SO2(g)和O2(g)置于密闭容器中充分反应后放出热量Q kJ,则此过程中有2 mol SO2(g)被氧化
D.X(g)+Y(g)
Z(g) ΔH >0,恒温恒容条件下达到平衡后加入X,上述反应ΔH增大
难度: 简单查看答案及解析
-
在C(s)+CO2(g)==2CO(g)的反应中,现采取下列措施:①缩小体积,增大压强 ②增加碳的量 ③通入CO2④恒容下充入N2 ⑤恒压下充入N2能够使反应速率增大的措施是( )
A.①④ B.②③⑤ C.①③ D.①②④
难度: 简单查看答案及解析
-
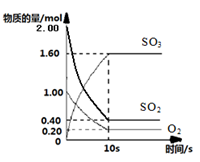
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。下列叙述正确的是( )

A.反应开始到10 s末时,用Z表示的反应速率为0.158 mol·L-1·s-1
B.反应开始到10 s末时,X的物质的量浓度减少了0.79 mol·L-1
C.反应开始到10 s时,Y的转化率为79.0%
D.反应的化学方程式为X(g)+Y(g)
Z(g)
难度: 简单查看答案及解析
-
在一定温度下的定容密闭容器中,当物质的下列物理量不再发生变化时,表明反应A(s)+2B(g)
C(g)+D(g)已达到平衡状态的是( )
A.混合气体的密度 B.混合气体的总物质的量
C.混合气体的压强 D.混合气体的总体积
难度: 简单查看答案及解析
-
可逆反应:2NO2(g)
2NO(g)+O2(g),在体积固定的密闭容器中,达到平衡状态的标志是( )
①单位时间内生成n mol O2
的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO
2、NO、O2表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A.①④⑥⑦ B.②③⑤⑦ C. ①③④⑤ D.全部
难度: 简单查看答案及解析
-
下列反应不需要加热就能进行的吸热反应是( )
A.碳酸钙分解
B.甲烷在氧气中燃烧
C.灼热的炭与二氧化碳反应
D.Ba(OH)2•8H2O与NH4Cl反应
难度: 简单查看答案及解析
-
据报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程如下图所示。下列说法中不正确的是 ( )

A.状态I→状态Ⅲ是放热过程
B.该过程中,CO没有断键形成C和O
C.状态I→状态Ⅲ表示CO和O生成了CO2
D.状态I→状态Ⅲ表示CO与O2反应的过程
难度: 简单查看答案及解析
-
反应 A+B→C(ΔH<0)分两步进行:①A+B→X (ΔH >0),②X→C(ΔH<0)。下列示意图中,能正确表示总反应过程中能量变化的是( )


难度: 中等查看答案及解析
-
根据以下3个热化学方程式
2H2S(g)+3O2(g)==2SO2(g)+2H2O(l) ΔH=-Q1 kJ·mol-1
2H2S(g)+O2(g)==2S(s)+2H2O(l) ΔH=-Q2 kJ·mol-1
2H2S
(g)+O2(g)==2S(s)+2H2O(g) ΔH=-Q3kJ·mol-1
判断Q1、Q2、Q3三者关系正确的是( )
A.Q1>Q2>Q3 B.Q1>Q3>Q2 C.Q3>Q2>Q1 D.Q2>Q1>Q3
难度: 简单查看答案及解析
-
已知乙醇、石墨和氢气的燃烧热分别为a、b、c(均为正值,单位均为kJ·mol-1)。则反应2C(s,石墨)+2H2(g)+H2O(l)==C2H5OH(l)的焓变为( )
A.(a-2b-2c) kJ·mol-1
B.(2b+2c-a) kJ·mol-1
C.(b+c-a) kJ·mol-1
D.(a-2b-c) kJ·mol-1
难度: 中等查看答案及解析
-
有些化学反应反应速率很慢且副反应较多,测定这些反应的焓变可运用( )
A.盖斯定律 B.勒夏特列原理
C.阿伏加德罗定律 D.质量守恒定律
难度: 简单查看答案及解析
-
最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如图所示,已知断裂1mol N﹣N吸收167 kJ热量,生成1mol N≡N放出942 kJ。根据以上信息和数据,下列说法正确的是( )
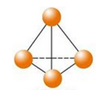
A.N4与N2互为同分异构体
B.1mo1N4气体转变为N2将吸收882 kJ热量
C.N4(g)═ 2N2(g) ΔH = - 882KJ
D.P4(白磷)的分子结构与N4相似,1mol N4和1mol P4均含有6mol非极性键
难度: 中等查看答案及解析
-
已知1 g氢气完全燃烧生成液态水时放出热量143 kJ,18 g水蒸气变成液态水放出44 kJ的热量。其他相关数据如下表:
O==O
H—H
H—O(g)
1 mol化学键断裂时需要吸收的能量/kJ
496
436
x
则表中
x为( )
A.920 B.557 C.463 D.188
难度: 中等查看答案及解析
-
硫代硫酸钠溶液与稀硫酸反应的化学方程式为Na2S2O3+H2SO4==Na2SO4+SO2↑+S↓+H2O,下列各组实验中最先出现浑浊的是( )
选
项
反应温度/℃
Na2S2O3溶液
稀H2SO4
H2O
V/mL
c/mol·L-1
V/mL
c/mol·L-1
V/mL
A
25
5
0.1
10
0.1
5
B
25
5
0.2
5
0.2
10
C
35
5
0.1
10
0.1
5
D
35
5
0.2
5
0.2
10
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而增大有效碰撞的次数
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数
D.催化剂不影响反应活化能但能增大单位体积内活化分子的百分数,从而增大反
应速率
难度: 简单查看答案及解析
-
足量块状铁与100 mL 0.01 mol/L的稀硫酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )。
①加H2O②加NaOH固体③加CH3COONa固体
④加Na2CO3固体⑤加入NaNO3固体⑥加NaCl溶液
⑦滴入几滴硫酸铜溶液⑧升高温度⑨将块状铁改为铁粉
⑩将稀硫酸改用98%的浓硫酸
A.⑧⑨⑩ B.⑦⑧⑨ C.③⑦⑩ D.⑦⑧⑩
难度: 中等查看答案及解析
-
为了应对能源危机,满足不断增大的能源需求,当今国际能源研究的另一热点就是寻找新能源,下列有关新能源的叙述不正确的是( )
A.氢能燃烧热值高,资源丰富,无毒,无污染
B.风能是太阳能的一种转换形式,能量巨大
C.世界上地热能蕴藏丰富,且已被用于采暖、温室、发电等方面
D.太阳能能量巨大,取之不尽,用之不竭,而且清洁、无污染,但需要开采、运输
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.人们把能够发生有效碰撞的分子叫做活化分子,同时把活化分子具有的能量叫活化能
B.化学反应不一定都有能量变化
C.活化能接近于零的反应,当反应物相互接触时,反应瞬间完成,而且温度对其反应速率几乎没有什么影响
D.活化能的大小不仅意味着一般分子成为活化分子的难易,也会对化学反应前后的能量变化产生影响
难度: 中等查看答案及解析