-
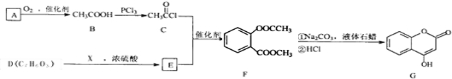
下列说法你认为不正确的是( )
A.实验室从苯酚中分离出苯的过程中,可选用如图装置及操作
B.化学反应中原子可重新组合、也可以破裂,爆炸过程中不一定伴随着化学反应
C.大气中的氮气可通过生物固氮、自然固氮和工业固氮等方式从游离态转变为化合态,氮的固定过程中必定发生氧化还原反应
D.化学家合成和分离了超过4500万种物质基础.化学合成和分离技术为信息技术、生物技术、航空航天技术等奠定了物质基础难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A.100mL1mol/LFeCl3溶液中含阳离子数为0.1NA
B.常温常压下1molNO2气体与水反应生成NA个NO3-离子
C.0.6gCaCO3与Mg3N2的混合物中所含质子数为0.3NA
D.80mL10mol/L浓盐酸与足量MnO2反应,转移电子数为0.4NA难度: 中等查看答案及解析
-
下列反应的离子方程式不正确的是( )
A.等体积、等物质量浓度的Ca(H2PO4)2溶液与NaOH溶液混合:Ca2++H2PO4-+OH-═CaHPO4↓+H2O
B.过量二氧化碳通入偏铝酸钠溶液中:CO2+2H2O+AlO2-=Al(OH)3↓+HCO3-
C.在溶液中亚硫酸氢铵与等物质的量氢氧化钠混合:NH4++HSO3-+2OH-=SO32-+NH3↑+2H2O
D.碳酸氢镁溶液中加入过量石灰水:Mg2++2HCO3-+2Ca2++4OH-=2CaCO3↓+Mg(OH)2↓+2H2O难度: 中等查看答案及解析
-
为了研究在温度对苯催化加氢的影响,以检验新型镍催化剂的性能.采用相同的微型反应装置,压强为0.78Mpa,氢气、苯的物质的量之比为6.5:1.定时取样分离出氢气后,分析成分得如下表结果:
下列说法错误的是( )温度/℃ 85 95 100 110~240 280 300 340 质量分数(%) 苯 96.05 91.55 80.85 23.35 36.90 72.37 环己烷 3.95 8.45 19.15 100 76.65 63.10 27.63
A.当温度超过280℃,苯的转化率迅速下降,可能是因为该反应为吸热的可逆反应
B.在110~240℃苯的转化率为100%.说明该镍催化剂活性较高,能够在较宽的温度范围内催化而且不发生副反应
C.提高氢气、苯的物质的量比都有利于提高苯的转化率
D.由表中数据来看,随着反应温度的升高,苯的转化率先升高后降低难度: 中等查看答案及解析
-
如图为某有机物的结构简式.已知酯类在铜铬氧化物催化下,与氢气反应得到醇,羰基双键可同时被还原,但苯环在催化氢化过程中不变,其反应原理如下:RCOOR′+2H2
RCH2OH+HO-R′.关于该化合物的下列说法中,不正确的是( )

A.该有机物的化学式为C20H14O5
B.该有机物可以与浓溴水反应
C.与足量氢氧化钠溶液充分反应,所得产物中有醇类物质
D.1mol该有机物在铜铬氧化物催化下仅能与2mol氢气发生反应难度: 中等查看答案及解析
-
前几年,部分巨能钙被检出含有双氧水,而双氧水有致癌性,可加速人体衰老.因此卫生部已开始加紧调查巨能钙.下列有关说法错误的是( )
A.H2O2、Na2O2都属于过氧化物,都存在共价键
B.双氧水是绿色氧化剂,可作医疗消毒剂
C.H2O2既有氧化性,又有还原性,与Cl2、KMnO4反应是表现H2O2的氧化性
D.H2O2做漂白剂是利用其氧化性,漂白原理与HClO类似、SO2不同难度: 中等查看答案及解析
-
常温下Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16,将等体积的AgCl和AgI的饱和溶液的清液混合,再向其中加入一定量的AgNO3固体,下列说法正确的是( )
A.两清液混合,AgCl和AgI都沉淀
B.向AgI清液加入AgNO3,c(Ag+)增大,KSp(AgI)也增大
C.若AgNO3足量,AgCl和AgI都可沉淀,但以AgCl为主
D.若取0.1435克AgCl固体放入100mL水(忽略体积变化),c(Cl-)为0.01mol/L难度: 中等查看答案及解析


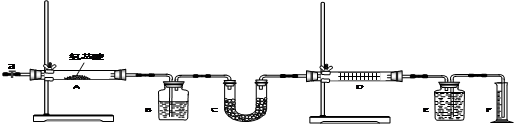


 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成