-
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A. 18gH2O含有10NA个质子
B. 标准状况下,22.4LCC14中含有的氯原子数目为4NA
C. 1 molN2与3molH2在一定条件下充分反应生成的NH3分子数为2NA
D. 78g苯中含有的碳碳双键的数目为3NA
难度: 中等查看答案及解析
-
科学家发现铂的两种化合物有不同的特性,a具有抗癌作用而b没有,则a和b属于 ( )

A. 同分异构体 B. 同素异形体 C. 同位素 D. 同一种物质
难度: 中等查看答案及解析
-
下列说法不正确的是
A. 风力、化石燃料、天然铀矿都是一次能源
B. 开发氢能、太阳能、风能、生物质能等新型能源是践行低碳生活的有效途径
C. 用脫硫处理的煤代替原煤作燃料可以有效减少空气中CO2气体的含量
D. 电能是现代社会中应用最广泛、使用最方便、污染最小的一种二次能源
难度: 简单查看答案及解析
-
在塑料袋中放一个成熟的苹果和一些青香蕉,将袋口密封,两天后青香蕉成熟了。导致青香蕉成熟的物质是成熟苹果释放出的
A. C2H4 B. CH3COOH C. C6H6 D. CH3CH2OH
难度: 简单查看答案及解析
-
下列叙述中正确的是( )
A. 周期表中第15列元素的最高价氧化物对应水化物的化学式均为H3RO4
B. O22-与S2-的具有相同的质子数和电子数
C. 所有主族元素的简单离子的带电荷数与其族序数相等
D. 氕化锂、氘化锂、氚化锂可以作为“长征2号”火箭发射的重要燃料,LiH、LiD、LiT的化学性质不同
难度: 中等查看答案及解析
-
我国稀土资源丰富,下列有关稀土元素
Sm与
Sm的说法正确的是( )
A. 通过化学变化可实现
Sm与
Sm的相互转化
B.
Sm与
Sm的核外电子排布方式相同
C. Sm元素的近似相对原子质量为150
D.
Sm与
Sm核外电子数和中子数均为62
难度: 简单查看答案及解析
-
下列不能证明Cl元素的非金属性强于S元素的是
A. HCl的稳定性强于H2S
B. Cl元素最高正价为+7,而S元素最高正价为+6
C. 将Cl2通入Na2S溶液中,产生黄色沉淀
D. 单质与H2化合所需的反应条件,S比Cl2苛刻
难度: 中等查看答案及解析
-
下列关于铷(
)的叙述正确的
A. 它在周期表的第5周期,第IA族
B. 氢氧化铷是弱碱,是一种离子化合物
C. 铷的一种核素
原子核内的中子数与电子数之差49
D. 在钠、钾、铷三种单质中,铷的熔点最高
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A. 带相反电荷的离子之间的相互吸引称为离子键
B. 非金属原子间不可能形成离子键
C. 金属元素与非金属元素化合时,一定形成离子键
D. 某元素的原子最外层只有一个电子,它跟卤素结合时形成的化学键不一定是离子键
难度: 简单查看答案及解析
-
固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体的最外电子层结构,则下列有关说法不正确的是( )
A. 1 mol NH5中含有5 NA个N﹣H键(NA表示阿伏加德罗常数)
B. NH5中既有共价键又有离子键
C. NH5的电子式为
D. 它与水反应的离子方程式为NH4++H﹣+H2O=NH3•H2O+H2↑
难度: 中等查看答案及解析
-
下列说法不正确的是 ( )
A. 碳酸钙受热分解中生成物总能量高于反应物总能量
B. 物质发生化学反应都伴随着原子的变化
C. 化学键的断裂和形成是化学反应中能量变化的根本原因
D. 化学反应必然伴随能量变化
难度: 简单查看答案及解析
-
下列说法正确的是
A.在化学反应中,化学能只可以转化为热能
B.合成氨工业中使用铁作催化剂以改变该反应的限度
C.SO2和O2合成SO3的反应中,升高温度,该反应速率减小
D.化学键的断裂和形成是化学反应中能量变化的主要原因
难度: 中等查看答案及解析
-
圣路易斯大学研制的新型乙醇燃料电池,使用能传递质子(H+)的介质作溶剂,反应原理为C2H5OH+3O2→2CO2+3H2O,下图是该电池的示意图,下列说法正确的是
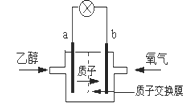
A. a极为电池的正极
B. 电池工作时,电流由a极沿导线经灯泡再到b极
C. 电池正极的电极反应为:4H++O2+4e-═2H2O
D. 电池工作时,1mol乙醇被氧化,则电路中有6mol电子转移
难度: 中等查看答案及解析
-
碱性电池具有容量大,放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应为: Zn(s)+2MnO2(s)+H2O(l)= Zn(OH)2 (s)+Mn2O3(s),下列说法错误的是 ( )
A. 电池工作时,锌失去电子
B. 电池正极的电极反应式为2MnO2(s)+H2O(l)+2e- = Mn2O3(s)+2OH-( aq)
C. 电池工作时,电子由正极通过外电路流向负极
D. 外电路中每通过0.2mol电子,锌的质量理论上减少6.5g
难度: 中等查看答案及解析
-
一定温度下,在一容积不变的密闭容器中发生的可逆反应2X(g)
Y(g)+Z(g),达到反应限度的标志是
①X的分解速率与X的生成速率相等 ②反应容器中压强不再变化
③X、Y、Z的浓度不再变化 ④单位时间内生成lmolY的同时生成lmolZ
A. ①③ B. ②③ C. ①② D. ②④
难度: 中等查看答案及解析
-
右图中a曲线表示一定条件下的可逆反应: X (g) + Y (g)
2Z(g) + W(s),正反应为放热反应。若使a曲线变为b曲线,可采取的措施是
A. 增大压强 B. 增大X的浓度 C. 升高温度 D. 加入W
难度: 中等查看答案及解析
-
关于有机物说法正确是的( )
A.有机物可分烃和烃的衍生物
B.含C化合物就是有机物
C.有机物都不溶于水,但易溶于有机溶剂
D.有机物都能燃烧
难度: 简单查看答案及解析
-
下列变化中,属于加成反应的是( )
A.乙烯使酸性KMnO4溶液褪色的反应
B.甲烷与氯气在光照条件下的反应
C.乙烯使溴水褪色的反应
D.乙烯的燃烧反应
难度: 中等查看答案及解析
-
下列关于有机物的说法中,不正确的是( )
A.液化石油气和天然气的主要成分都是甲院
B.苯、乙醇和乙酸都能发生取代反应
C.油脂在碱的催化作用下可发生水解,工业上利用该反应生产肥皂
D.煤的气化是化学变化,石油分馏是物理变化
难度: 中等查看答案及解析
-
下列说法中正确的是
A. 无论乙烯的加成,还是乙烷的取代反应都可制得氯乙烷
B. 使用溴水或酸性高锰酸钾溶液都可以除去乙烷中的乙烯杂质
C. 相同质量的乙烯和甲烷完全燃烧后产生的水的质量相同
D. 乙烯的化学性质比乙烷的化学性质活泼
难度: 简单查看答案及解析
-
有一种有机物的结构简式为R—CH=CH—COOH,式中的R为烷基,下列关于这种有机物的叙述中错误的是
A.若能溶于水,其水溶液与镁反应能放出氢气
B.可以使溴水和酸性高锰酸钾溶液褪色
C.不能发生加成反应
D.可以与乙醇在一定条件下发生酯化反应
难度: 困难查看答案及解析
-
乙醇中的各种化学键如图所示,关于乙醇在各种反应中断裂键的说法不正确的是
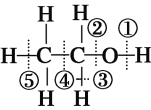
A.和金属钠反应时键①断裂
B.在铜催化共热下与O2反应时断裂①和③
C.在浓硫酸催化共热下与乙酸反应时断裂②
D.在空气中完全燃烧时断裂①②③④⑤
难度: 中等查看答案及解析
-
下列关于煤、石油、天然气等资源的说法正确的是( )
A. 把煤加强热,使它发生物理和化学的变化过程叫做煤的干馏
B. 石油产品都可用于聚合反应
C. 天然气除可用做清洁能源外,也可用于合成氨和生产甲醇等
D. 焦炉气的主要成份是一氧化碳和二氧化碳
难度: 中等查看答案及解析
-
从海带中提取碘要经过灼烧、浸取、过滤、氧化、萃取、分液、蒸馏等操作,下列对应的装置合理,操作规范的是( )
A. 海带灼烧成 灰
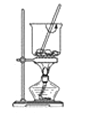 B. 过滤含碘离子溶液
B. 过滤含碘离子溶液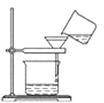 C. 放出碘的苯溶液
C. 放出碘的苯溶液 D. 分离碘并回收苯
D. 分离碘并回收苯
难度: 简单查看答案及解析
-
可逆反应m A(s)+n B(g)
e C(g)+f D(g),反应过程中,当其他条件不变时,C的体积分数φ(C)在不同温度和不同压强的条件下随时间的变化如图所示。下列叙述正确的是( )

A.平衡后,若使用催化剂,C的体积分数将增大
B.平衡后,若温度升高,化学平衡向正反应方向移动
C.平衡后,增加A的质量化学平衡向正反应方向移动
D.化学方程式中,化学计量数的关系为n<e +f
难度: 困难查看答案及解析