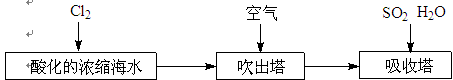
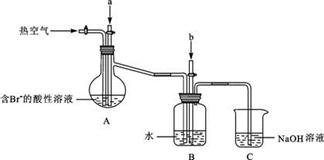
-
设NA代表阿伏加德罗常数的值,下列说法正确的是
A.常温常压下22.4L SO2所含的分子数为NA
B.标准状况下22.4L CCl4所含的原子数为5NA
C.1L 1mol/L CaCl2溶液中所含的Cl-离子数为2NA
D.56 g Fe与任何物质完全反应时转移的电子数一定为2NA
难度: 中等查看答案及解析
-
下列化学反应的离子方程式正确的是:
A.氯化铁溶液中加入铁粉: Fe3+ + Fe = 2Fe2+
B.氯化亚铁溶液中通入氯气: 2Fe2+ +Cl2=" 2" Fe3+ + 2Cl -
C.AlCl3溶液中加入过量氨水: Al3++4OH- = AlO2-+2H2O
D.实验室用大理石和稀盐酸制取CO2:2H+ + CO32- = CO2↑+ H2O
难度: 中等查看答案及解析
-
自来水厂用氯气给水消毒,对其消毒原理描述正确的是
A.利用氯气的毒性 B.利用氯气与水反应生成的HClO具有强氧化性
C.利用 氯气的漂白性 D.利用氯气与水反应生成的HCl具有强酸性
难度: 中等查看答案及解析
-
下图所示的实验操作,不能达到相应目的的是

难度: 中等查看答案及解析
-
我国的“神舟五号”载人飞船已发射成功, “嫦娥”探月工程也已正式启动。据科学家预测,月球的土壤中吸附着数百万吨的
He,每百吨
He核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以
He的形式存在。下列说法正确的是
A.
He原子核内含有4个质子 B.
He和
He互为同 位素
C.
He原子核内含有3个中子 D.
He具有较强的金属性
难度: 简单查看答案及解析
-
下列有关碱金属的说法中,正确的是
A.金属锂应保存在煤油中
B.金属钾着火应用泡沫灭火剂更好
C.它们都能在空气里燃烧生成M2O(M表示碱金属)
D.碱金属单质随着核电荷数的递增与水反应的剧烈程度逐渐加剧直至燃烧爆炸
难度: 中等查看答案及解析
-
检验氯化氢气体中是否混有 Cl2,可采用的方法是
A.用干燥的蓝色石蕊试纸 B.用干燥有色布条
C.将气体通入硝酸银溶液 D.用湿润的淀粉碘化钾试纸
难度: 中等查看答案及解析
-
核内中子数为N的R2+离子,质量数为A,则n g它的氧化物中所含质子的物质的量是
A.
(A-N+8)mol B.
(A-N+10)mol
C.(A-N+2)mol D.
(A-N+6)mol
难度: 中等查看答案及解析
-
X、Y、Z和R分别代表4种元素,如果aXm+,bYn+,cZn-,dRm-4种离子的电子层结构相同(a、b、c、d为元素的原子序数),则下列关系正确的是
A.a-c=m-n B.a-b=n-m C.c-d=m+n D.b-d=n+m
难度: 中等查看答案及解析
-
最稳定的卤化氢是
A.HF B.HCl C.HBr D.HI
难度: 简单查看答案及解析
-
X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且 X、Y、Z相邻。X的核电荷数为Y的核外电子数的一半,Y与M可形成化合物M2Y。下列说法正确的是
A.稳定性:X的氢化物>Y的氢化物>Z的氢化物
B.简单离子的半径:M的离子>Z的离子>Y的离子>X的离子
C.YX2、M2Y都是含有极性键的极性分子
D.Z元素的最高价氧化物的水化物的化学式为HZO4
难度: 困难查看答案及解析
-
下列物质性质的递变中,不正确的是
A.HCl、H2S、PH3的稳定性依次减弱
B.HClO4、H2SO4、H3PO4、H4SiO4的酸性依次减弱
C.CSOH、KOH、LiOH的碱性依次减弱
D.Br2、Cl2、F2的氧化性依次减弱
难度: 中等查看答案及解析
-
下列物质中,均含有共价键的离子化合物的一组是
①MgF2 ②Na2O2 ③NaOH ④NH4Cl ⑤CO2 ⑥H2O2 ⑦N2
A.②③④⑤⑦ B.②③④ C.①②③④⑥ D.①③⑤⑥
难度: 中等查看答案及解析
-
已知反应A+B=C +D的能量变化如下图所示,下列说法正确的是
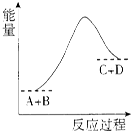
A.该反应为放热反应
B.该反应为吸热反应
C.反应物的总能量高于生成物的总能量
D.该反应只有在加热条件下才能进行
难度: 简单查看答案及解析
-
下图是氢氧燃料电池构造示意图。关于该电池的说法,不正确的是

A.a极是负极
B.该电池总反应为2H2+O2
2H2O
C.电子由b通过灯泡流向a
D.氢氧燃料电池是环保电池
难度: 中等查看答案及解析
-
下列根据实验操作和现象所得出的结论正确的是
选项 实验操作 实验现象 结 论
A. 将气体X通入品红溶液中 红色褪去 X一定是SO2
B. 向无色溶液中加硝酸酸化的BaCl2溶液 有白色沉淀 原溶液中定含SO42-
C. 向Na2SiO3溶液中通入适量CO2气体 出现白色沉淀 H2CO3的酸性比H2SiO3强
D. 向某溶液 中先加氯水再加KSCN溶液 溶液呈血红色 原溶液中定含Fe2+
难度: 中等查看答案及解析
-
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如右图所示,由此确定,原溶液中含有的阳离子是:
A.H+、Al3+、Fe2+ B.H+、Mg2+、Al3+
C.H+、Ba2+、Al3+ D.只有Mg2+、Al3+
难度: 中等查看答案及解析
-
已知1-18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系式正确的是
A.质子数:c>b B.离子的还原性:Y2->Z-
C.氢化物的稳定性:H2Y<HZ D.原子半径:X<W
难度: 中等查看答案及解析
-
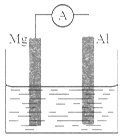
有a、b、c、d 4种金属,将a与b用导线连接起来,浸入电解质溶液中,b不易腐蚀;将a、d分别投入等浓度的盐酸中,d 比a反应剧烈;将铜浸入b的盐溶液中,无明显变化;如果把铜浸入c的盐溶液中,有金属c析出。据此判断它们的活动性由强到弱的顺序是
A.d>c>a>b B.d>a>b>c
C.d>b>a>c D.b>a>d>c
难度: 中等查看答案及解析
-
某溶液中可能含有以下6种离子中的几种:NH4+、A13+、Mg2+、CO32-、Cl一、SO42-,为确认溶液组成,现取三份各 100 mL。溶液进行如下实验:
(1)向第一份溶液中加入 AgNO3溶液有沉淀产生;
(2)向第二份溶液中加入过量NaOH溶液充分反应后,最终得到沉淀0.58 g(经过滤、洗涤、干燥,下同),同时收集到气体0.03 mol(设气体全部从溶液中逸出);
(3)向第三份溶液中加入足量BaCl2溶液(盐酸酸化)充分反应后,得到沉淀6.99 g。
由此可知,下列关于原溶液组成的正确结论是
A.一定存在A13+、M g2+、NH4+和SO42- B.一定存在Cl一
C.一定不存在Mg2+,可能存在A13+ D.溶液中SO42-的浓度是0.03 mol/L
难度: 困难查看答案及解析
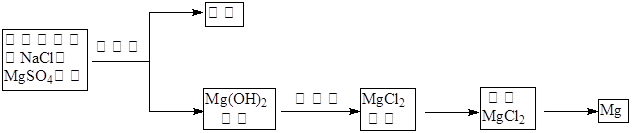 试剂①宜选用石灰乳且必须过量,过量的目的是________.
试剂①宜选用石灰乳且必须过量,过量的目的是________.