-
下表是部分短周期元素的原子半径及主要化合价,根据表中信息,判断以下叙述正确的是

A.L2+与R2-的核外电子数相等
B.M与T形成的化合物既能与酸反应又能与强碱反应
C.氢化物的稳定性为H2T<H2R
D.单质与浓度相等的稀盐酸反应的速率为Q>L
难度: 中等查看答案及解析
-
下列说法正确的是
A.Li是最活泼金属,F是最活泼非金属
B.Mg(OH)2碱性比Ca(OH)2强
C.元素周期表有7个主族,7个副族,1个O族,1个VII族,共16个纵行
D.X2+的核外电子数目为18,则X在第四周期第IIA族
难度: 中等查看答案及解析
-
化学科学需要借助化学专用语言描述,下列有关化学用语正确的是
A.羟基的电子式为:
B. HClO的结构式:H—Cl—O
C.丙烷分子的比例模型:

D. S2-的结构示意图:

难度: 简单查看答案及解析
-
短周期的三种元素X、Y、Z,已知X 元素的原子核外只有一个电子,Y元素的原子M层上的电子数是它的内层电子总数的一半,Z元素原子的L层上的电子数比Y元素原子的L层上的电子数少2个,则这三种元素所组成的化合物的化学式不可能是
A.X2YZ4 B.XYZ3 C.X3YZ4 D.X4Y2Z7
难度: 中等查看答案及解析
-
下列关于原子结构、元素性质的说法正确的是
A.非金属元素组成的化合物中只含共价键
B.IA族金属元素是同周期中金属性最强的元素
C.同种元素的原子均有相同的质子数和中子数
D.VIIA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强
难度: 中等查看答案及解析
-
下列大小比较正确的是
A.离子半径:Na+>Mg2+>Al3+>Cl- ; 原子半径:Na>Mg>Al>Cl
B.稳定性:HF>H2O>NH3>CH4; 还原性:HF<H2O<NH3<CH4
C.碱性:CsOH>KOH>Mg (OH)2>NaOH; 金属性:Cs>K>Mg>Na
D.酸性:HClO>H2SO4>H2CO3; 非金属性:Cl>S>C
难度: 中等查看答案及解析
-
下列措施对增大反应速率明显有效的是
A.Na与水反应时增大水的用量
B.在K2SO4与BaCl2两溶液反应时,增大压强
C.将铝片改为铝粉,做铝与氧气反应的实验
D.Fe与稀硫酸反应制取氢气时,改用浓硫酸
难度: 中等查看答案及解析
-
在一密闭容器中充入一定量的H2和N2经测定反应开始后3s末的V(H2)=0.3 mol·L-1·s-1,则3s末NH3的浓度为
A.0.4 mol·L-1 B.0.6 mol·L-1 C.0.9 mol·L-1 D.1.2 mol·L-1
难度: 中等查看答案及解析
-
一定温度下,某一密闭恒容的容器内可逆反应2SO2+O2
2SO3达到平衡的标志是
①消耗2 mol SO2的同时生成2 mol SO3
②SO2、O2与SO3的物质的量之比为2:1:2
③反应混合物中,SO3的质量分数不再改变
④当生成SO3的速率为0时
⑤容器内混合气体的密度不随时间而变化
⑥容器内SO2与SO3的物质的量之和不变
A.①②④ B.①③⑤ C.③⑥ D.③
难度: 中等查看答案及解析
-
据媒体报道,以氢氧燃料电池为动力的公交车即将在北京试运行。质子交换膜燃料电池(PEMFC) 常作为电动汽车的动力源。该燃料电池以氢气为燃料,空气为氧化剂,铂作催化剂,导电离子是H+。下列对该燃料电池的描述中正确的是
①正极反应为:O2+4H++4e- ═2H2O
②负极反应为:2H2-4e- ═4H+
③总的化学反应为:2H2+O2
2H2O
④H+通过电解质向正极移动
A.①②③④ B.②③④ C.①②④ D.①②③
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列有关叙述正确的是
A.标准状况下,1L庚烷完全燃烧后,所生成的气态产物的分子数为
B.100ml 0.1mol/L CH3COOH溶液跟足量锌反应,生成的氢气分子数为0.01NA
C.0.1mol CH4所含质子数为NA
D.0.5mol C2H4中含有的C=C双键数为NA
难度: 困难查看答案及解析
-
下列各反应属于加成反应的是
A.CH4+2O2
CO2+2H2O
B.CH2=CH2+Br2
CH2Br—CH2Br
C.CH4+Cl2
CH3Cl+HCl
D.2CH3CH2OH+O2
2CH3CHO+2H2O
难度: 中等查看答案及解析
-
若甲烷与氯气以物质的量之比1:3混合,在光照下得到的产物:①CH3Cl;②CH2Cl2;③CHCl3;④CCl4,其中正确的是
A.只有① B.只有②
C.①②③的混合物 D.①②③④的混合物
难度: 中等查看答案及解析
-
下列说法正确的是
A.
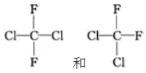 是两种不同的物质
是两种不同的物质B.由乙烯之间相互加成可以得到聚乙烯
C.丁烷有3种同分异构体
D.1mol乙酸与足量乙醇在浓硫酸催化作用下加热,可生成1mol乙酸乙酯
难度: 中等查看答案及解析
-
两种大气污染物NO2和SO2在一定条件下可发生如下反应:NO2 + SO2
NO + SO3,在体积为VL的密闭容器中通入a mol NO2和b mol SO2,反应后容器内硫原子和氧原子的个数比为
A.
B.
C.
D.
难度: 困难查看答案及解析
-
括号内物质为杂质,下列除去杂质的做法不正确的是
A.乙酸乙酯(乙酸和乙醇):用饱和Na2CO3溶液洗涤后分液
B.乙烷(乙烯):用浓溴水洗气
C.乙醇(乙酸):用NaOH溶液中和后分液
D.乙醇(水):用生石灰吸水后蒸馏
难度: 中等查看答案及解析

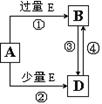



 可能发生的化学反应有
可能发生的化学反应有