-
已知:①CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH1;
②2H2(g)+O2(g)===2H2O(g) ΔH2;③2H2(g)+O2(g)===2H2O(l) ΔH3。
室温取体积比为4∶1的甲烷和氢气的混合气体11.2 L(已换算成标准状况),经完全燃烧后恢复至室温,放出的热量为( )
A. -(0.4mol×ΔH1+0.05mol×ΔH3) B. -(0.4mol×ΔH1+0.05mol×ΔH2)
C. -(0.4mol×ΔH1+0.1mol×ΔH3) D. -(0.4mol×ΔH1+0.1mol×ΔH2)
难度: 中等查看答案及解析
-
为建设生态文明、构建环境友好型社会,下列有关做法不符合这一要求的是( )
A. 在大力推广乙醇汽油的同时,研究开发太阳能电池和氢燃料电池汽车
B. 大力发展农村沼气, 将废弃的农作物秸秆转化为清洁、 高效的能源
C. 研发高效低毒农药,降低蔬菜的农药残留量
D. 以聚苯乙烯全面代替木材,生产包装盒、 快餐盒等以减少木材的使用,保护森林
难度: 简单查看答案及解析
-
在1 200 ℃时,天然气脱硫工艺中会发生下列反应
H2S(g)+
O2(g)=SO2(g)+H2O(g) ΔH1
2H2S(g)+SO2(g)=
S2(g)+2H2O(g) ΔH2
H2S(g)+
O2(g)=S(g)+H2O(g) ΔH3
2S(g)=S2(g) ΔH4
则ΔH4的正确表达式为( )
A. ΔH4=
(ΔH1+ΔH2-3ΔH3) B. ΔH4=
(3ΔH3-ΔH1-ΔH2)
C. ΔH4=
(ΔH1+ΔH2-3ΔH3) D. ΔH4=
(ΔH1-ΔH2-3ΔH3)
难度: 中等查看答案及解析
-
在36 g 碳不完全燃烧所得气体中,CO占
体积,CO2占
体积,且C(s) +
O2(g) = CO(g) △H= -110.5 kJ/mol,CO(g) +
O2(g) = CO2(g)△H= -283 kJ/mol,这些碳完全燃烧相比,损失的热量是( )
A. 172.5kJ B. 1149kJ C. 517.5 kJ D. 283kJ
难度: 中等查看答案及解析
-
航天飞船可用肼(N2H4)和过氧化氢(H2O2)为动力源。已知1 g液态肼和足量液态过氧化氢反应生成氮气和水蒸气时放出20.05 kJ的热量。下列说法中错误的是( )
A. 液态肼的燃烧热为20.05 kJ·mol-1
B. 该反应中肼作还原剂
C. 该动力源的突出优点之一是生成物对环境污染小
D. 肼和过氧化氢反应的热化学方程式为N2H4(l)+2H2O2(l)===N2(g)+4H2O(g) ΔH=-641.6 kJ·mol-1
难度: 中等查看答案及解析
-
下列说法正确的是
A. 增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大
B. 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C. 升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数
D. 催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率
难度: 中等查看答案及解析
-
一定温度下反应N2+O2
2NO在密闭容器中进行,下列措施不改变化学反应速率的是( )
A. 缩小体积使压强增大 B. 恒容,充入N2
C. 恒容,充入He D. 恒压,充入氩气
难度: 简单查看答案及解析
-
用铁片与稀硫酸反应制取氢气时,下列措施能使氢气生成速率加大的是( )
A. 加少量CH3COONa固体 B. 加硝酸钾固体
C. 不用铁片,改用铁粉 D. 不用稀硫酸,改用98%浓硫酸
难度: 简单查看答案及解析
-
反应C(s)+H2O(g)
CO(g)+H2(g),在一可变容积的密闭容器中进行,下列条件改变对其反应速率几乎无影响的是( )
A. 升高温度 B. 体积缩小一半
C. 压强不变,充入氮气使体积增大 D. 体积不变,充入氮气使压强增大
难度: 简单查看答案及解析
-
氨气能发生氧化反应:4NH3+5O2=4NO+6H2O,改变下列条件使反应速率加大,其中是由于增大了“活化分子”的百分数的是( )
A. 增加NH3浓度 B. 缩小体积增大压强
C. 升高温度 D. 降低温度
难度: 中等查看答案及解析
-
在带有活塞的密闭容器中发生反应:Fe2O3+3H2=2Fe+3H2O(g),采取下列措施能改变反应速率的是( )
A. 增加Fe2O3的量 B. 保持容器体积不变,增加H2输入量
C. 减少Fe的量 D. 保持容器体积不变,增加H2O(g)
难度: 简单查看答案及解析
-
已知4NH3+5O2=4NO+6H2O,若反应速率分别用V(NH3)、V(O2)、V(NO)、V(H2O) 表示。则正确的关系是( )
A.
V(NH3)=V(O2) B.
V(O2)=V(H2O)
C.
V(NH3)=V(H2O) D.
V(O2)=V(NO)
难度: 简单查看答案及解析
-
NH3和纯净的O2在一定条件下发生反应:4NH3(g)+3O2(g)
2N2(g)+6H2O(g),现向一容积不变的2L密闭容器中充入4molNH3和3molO2,4min后,测得生成的H2O占混合气体体积的40%,则下列表示此段时间内该反应的平均速率不正确的是( )
A. V(NH3)=0.250moL·L-1·min-1 B. V(H2O)=0.375moL·L-1·min-1
C. V(N2)=0.125moL·L-1·min-1 D. V(O2)=0.225moL·L-1·min-1
难度: 中等查看答案及解析
-
某研究性活动小组在实验室用三份不同初始浓度的氨基甲酸铵(NH2COONH4)溶液在不同温度下进行水解实验:NH2COONH4+2H2O
NH4HCO3+NH3·H2O,经测得c(NH2COO-)与反应时间的关系如图所示。据图判断下列说法正确的是( )
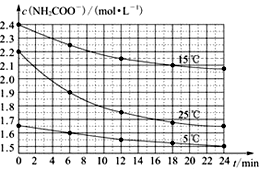
A. 0~12 min,初始浓度越大的实验,水解反应速率越大
B. c(NH2COO-)将随反应时间的不断延长而一直减小至0
C. 15 ℃时,第30 min时,c(NH2COO-)为2.0 mol·L-1
D. 25 ℃时0~6 min,v(NH2COO-)为0. 05 mol·L-1·min-1
难度: 中等查看答案及解析
-
在一定条件下,N2O分解的部分实验数据如下( )
反应时间/min
0
10
20
30
40
50
60
70
80
90
100
c(N2O)/mol•L-1
0.100
0.090
0.080
0.070
0.060
0.050
0.040
0.030
0.020
0.010
0.000
下图能正确表示该反应有关物理量变化规律的是( )
(注:图中半衰期指任一浓度N2O消耗一半时所需的相应时间,c1、c2均表示N2O初始浓度且c1<c2)
A.
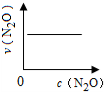 B.
B.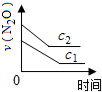 C.
C.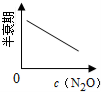 D.
D.
难度: 困难查看答案及解析